
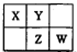
| A.元素X和元素W最高正价代数和一定为8 |
| B.若元素X的原子序数为a,则Z的原子序数一定为a+9 |
| C.常温下,若X的简单氢化物的水溶液能使红色石蕊试液变蓝,则元素Y的简单氢化物的沸点一定高于元素W的简单氢化物 |
| D.原子半径的大小顺序为:rW>rZ>rX>rY |
科目:高中化学 来源:不详 题型:单选题
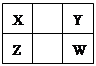
| A.Z元素的原子半径可能比Y元素的小 |
| B.Z的原子序数不可能是X的原子序数的2倍 |
| C.W的气态氢化物的稳定性一定比Y的强 |
| D.Z的最高价氧化物的水化物的酸性一定比W的强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
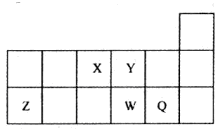
| A.元素W的最高价氧化物对应的水化物的酸性比Q的强 |
| B.原子半径的大小顺序为:X>Y>Z>W>Q |
| C.离子Y2-和Z3+的核外电子数和电子层数都不相同 |
| D.元素Y与元素W的最高化合价的数值等于其族序数 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 部分结构知识 | 部分性质 |
| X | X原子核外电子占有9个原子轨道 | X的一种氧化物是形成酸雨的主要物质 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
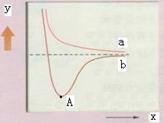
| A.y代表两原子之间的核间距 |
| B.x代表体系具有的能量 |
| C.a代表核外电子自旋相反的两个氢原子能量变化 |
| D.A点时表示两原子间形成了稳定的共价键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com