
【题目】用容量瓶配制一定物质的量浓度的NaCl溶液的实验中,会使所配溶液浓度偏高的是
A. 定容时加水加多了,用滴管吸出溶液至刻度线
B. 定容时仰视刻度线
C. 没有洗涤溶解NaCl固体的烧杯和玻璃棒
D. 称量NaCl固体时砝码上有杂质
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】电解法生产锰时会产生大量的阳极泥,其主要成分为MnO2和Pb,还含有少量其他金属化合物。下图是回收电解锰阳极泥生产MnCO3的工艺流程。

已知:Al(OH)3、Mn(OH)2、MnCO3的Ksp分别为1.0×10-33、1.9×10-13、2.2×10-11。
(l)“还原酸浸”时氧化产物为CO2,发生反应的化学方程式为____。
(2)“还原酸浸”实验中,锰的浸出率结果如图所示。由图可知,所采用的最佳实验条件为 ____ 。

(3)滤液l中的阳离子组成见下表:
组成 | Mn2+ | Fe2+ | Fe3+ | Al3+ |
浓度/(mol·L-1) | 0.85 | 2.4×10-3 | 1.0×10-2 | 2.0×10-3 |
“除杂”时先加MnO2,MnO2的作用为 ___。
再加氨水调节pH使杂质离子沉淀完全,通过计算说明Al3+沉淀完全时Mn2+是否开始沉淀 ___。
(4)“沉锰”时发生反应的离子方程式为 ___。
(5)“沉锰”的关键操作有2点:①将NH4HCO3溶液滴入MnSO4溶液中;②反应终点pH=7。如果颠倒试剂滴加顺序,将MnSO4溶液滴人NH4HCO3,溶液中,或反应终点pH>7可能造成同样的后果,该后果是____;如粜反应终点pH<7,可能的后果是______。
(6)从滤液2中回收得到的副产品的用途为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝( AlN)是一种新型无机非金属材料,常温下AlN +NaOH+H2O=NaAlO2+NH3↑。某课题小组利用甲图所示装置测定样品中AlN的含量(杂质不反应)。下列说法中正确的是
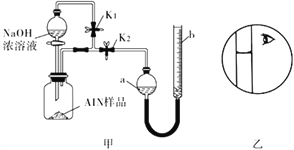
A. 量气管中的液体应为水
B. 用长颈漏斗代替分液漏斗,有利于控制反应速率
C. 反应结束时,a、b两管液面的差值即为产生气体的体积
D. 若其它操作均正确,实验结束时按乙图读数,测得AlN含量偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电.其电池反应为:2CH3OH+3O2+4OH﹣ ![]() 2CO32﹣+6H2O,则下列说法错误的是( )
2CO32﹣+6H2O,则下列说法错误的是( )
A.放电时CH3OH参与反应的电极为正极
B.充电时电解质溶液的pH逐渐增大
C.放电时负极的电极反应为:CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O
D.充电时每生成1molCH3OH转移6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠具有强氧化性,遇木炭、铝粉等还原性物质时可燃烧.下列有关说法不正确的是( )
A.Na2O2与CO2反应时,Na2O2是氧化剂,CO2是还原剂
B.1mol过氧化钠中阴离子数目为1NA
C.过氧化钠与木炭、铝粉反应时,过氧化钠均表现出强氧化性
D.过氧化钠与二氧化硫反应时可生成硫酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Al2O3、Fe及其它不溶于酸、碱的杂质。部分金属氢氧化物Ksp近似值如下表所示:如下:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-39 | 10-34 | 10-15 |
现用含镍废催化剂制备NiSO4·7H2O晶体,其流程图如下:

回答下列问题:
(1)“碱浸”时发生反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,________________。
(2)“酸浸”所使用的酸为_____________。
(3)“净化除杂”需加入H2O2溶液,其作用是__________________________。然后调节pH使溶液中铁元素恰好完全沉淀,列式计算此时的pH。___________________________
(4)“操作A”为_____、过滤、洗涤、干燥,即得产品。
(5)NiSO4在强碱性溶液中可被NaClO氧化为NiOOH,该反应的离子方程式为__________________。
(6)NiOOH可作为镍氢电池的电极材料,该电池的工作原理如下图所示,其放电时,正极的电极反应式为__________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )

A. 在0~a范围内,只发生中和反应
B. a=0.3
C. ab段发生反应的离子方程式为CO32-+2H+=CO2↑+H2O
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com