
分析 发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,n(H2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,结合电子守恒及反应计算.
解答 解:(1)n(H2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,由电子守恒可知,n(Al)=$\frac{0.3mol×2×(1-0)}{(3-0)}$=0.2mol,其质量为0.2mol×27g/mol=5.4g,
答:所加铝粉的质量为5.4g;
(2)由2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,生成氢气0.3mol,消耗NaOH为0.2mol,则反应后溶液中NaOH的物质的量浓度为$\frac{0.2L×2mol/L-0.2mol}{0.2L}$=1mol/L,
答:反应后溶液中NaOH的物质的量浓度为1mol/L.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的氧化还原反应、电子守恒为解答的关键,侧重分析与应用能力的考查,注意守恒法的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
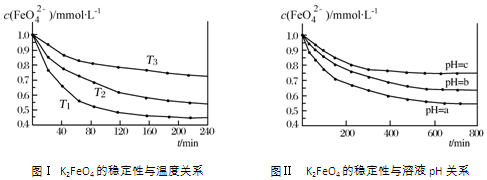
| A. | 由图Ⅰ可知K2FeO4的稳定性随温度的升高而减弱 | |
| B. | 由图Ⅰ可知温度:T1>T2>T3 | |
| C. | 由图Ⅰ可知上述反应△H<0 | |
| D. | 由图Ⅱ可知图中a<c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
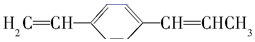 的说法正确的是( )
的说法正确的是( )| A. | 所有原子都在同一平面上 | |
| B. | 最多有4个碳原子在同一直线上 | |
| C. | 有7个碳原子可能在同一直线上 | |
| D. | 最多只能有9个碳原子在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,请完成下列空白:
,请完成下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 纳米级Cu2O由于具有优良的催化性能而受到关注,表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,表为制取Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法:2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$ Cu2O+H2↑ |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
| 序号 | 0 | 10 | 20 | 30 | 40 | 50 | |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
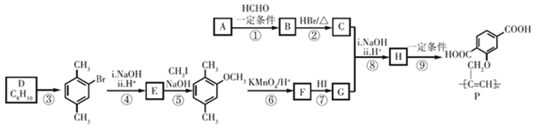
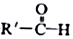 $\stackrel{一定条件}{→}$R-C≡
$\stackrel{一定条件}{→}$R-C≡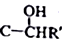
 +CH2I$\stackrel{NaOH}{→}$
+CH2I$\stackrel{NaOH}{→}$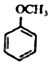 +NaI+H2O
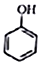
+NaI+H2O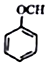 +HI→
+HI→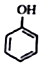 +CH2I
+CH2I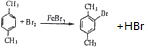 .
.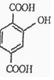 .
.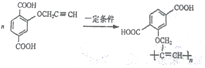 .
.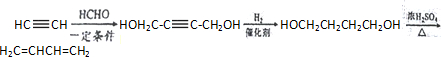 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、CO32、AlO2- | B. | SO42-、AlO2-、K+、CO32-、 | ||
| C. | CO32-、K+、Al3+ | D. | MnO4-、K+、CO32-、NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com