
 | 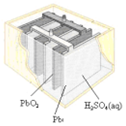 | 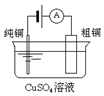 | 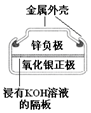 |
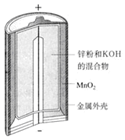
| 图Ⅰ碱性锌锰电池 | 图Ⅱ铅蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
| A. | 图Ⅰ所示电池中,锌为负极,MnO2的作用是催化剂 | |
| B. | 图II所示电池二氧化铅为正极,放电过程中硫酸浓度不变 | |
| C. | 图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变 | |
| D. | 图IV所示电池工作过程中,Ag2O是氧化剂 |
分析 A.二氧化锰作正极;
B.根据放电过程中电池反应判断浓硫酸浓度变化;
C.粗铜中不仅含有铜还含有其它金属,根据转移电子守恒判断溶液中铜离子浓度是否变化;
D.在氧化还原反应中,得电子化合价降低的是氧化剂.
解答 解:A.该电池反应中二氧化锰得到电子被还原,为原电池的正极,故A错误;
B.铅蓄电池放电时电池反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,该反应中浓硫酸参加反应,所以浓度降低,故B错误;
C.粗铜中不仅含有铜还含有其它金属,电解时,粗铜中有铜和其它金属失电子,纯铜上只有铜离子得电子,所以阴极上析出的铜大于阳极上减少的铜,所以溶液中铜离子浓度降低,故C错误;
D.该原电池中,正极上氧化银得电子生成银,所以氧化剂作氧化剂发生还原反应,故D正确;
故选D.
点评 本题考查原电池和电解池原理,明确电极上发生的反应是解本题关键,难度不大.


科目:高中化学 来源: 题型:实验题
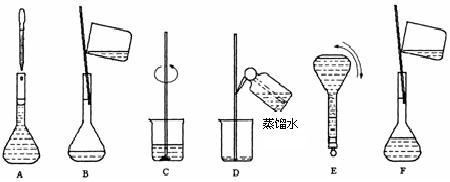
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molH2O所含质子数为8NA | |
| B. | 1摩尔氦气所含的原子数为2NA | |
| C. | 在标准状况下1L水所含分子数为$\frac{1}{22.4}$NA | |
| D. | 0.5molaL与足量盐酸反应转移的电子数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
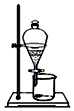 |  |  |  |
| 用酒精萃取碘水中的碘 | 烧杯中的Fe(OH)3胶体可产生丁达尔效应 | 蔗糖遇浓硫酸变黑,说明浓硫酸有脱水性 | Fe(OH)2白色沉淀迅速变成灰绿色,最后变成红褐色,说明Fe(OH)2易被氧化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
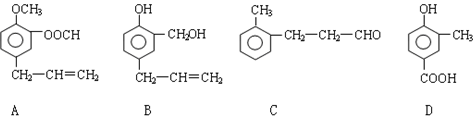
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
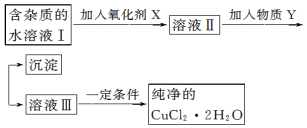
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的 pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的 pH | 3.0 | 9.0 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g H2O含有的氢原子数目为NA | |
| B. | 标准状况下,22.4LCO2含有的分子数目为NA | |
| C. | 1mol•L-1K2SO4溶液中含有的钾离子数目为2NA | |
| D. | 1mol H2在O2中完全燃烧转移的电子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
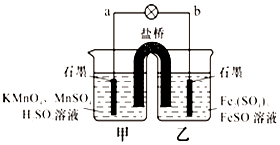 某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )
某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )| A. | 外电路的电流方向是从a到b | |
| B. | 甲烧杯中溶液的pH逐渐减小 | |
| C. | 电池工作时,盐桥中的SO42-移向甲烧杯 | |
| D. | 乙烧杯中发生还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com