
| A. | FeS2作还原剂,铁元素被还原 | |
| B. | Fe2O3和SO2都既是氧化产物又是还原产物 | |
| C. | 每生成1 mol Fe2O3,有4mol硫被氧化 | |
| D. | 每1 mol硫被氧化,转移电子5.5mol |
分析 4FeS2+11O2=2Fe2O3+8SO2中,Fe、S元素的化合价升高,O元素的化合价降低,以此来解答.
解答 解:A.Fe元素的化合价升高,铁元素被氧化,故A错误;
B.Fe、S元素的化合价升高,O元素的化合价降低,则Fe2O3和SO2都既是氧化产物又是还原产物,故B正确;
C.由方程式可知,生成2molFe2O3,有4molFeS2参加反应,8molS被氧化,则每生成1 mol Fe2O3,有4mol硫被氧化,故C正确;
D.4mol FeS2发生反应时,8molS被氧化,11mol氧气得到电子,反应中共有11mol×2×2=44mol电子转移,则每1 mol硫被氧化,转移电子5.5mol,故D正确.
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | N2是还原产物,且还原剂与氧化剂物质的量之比是2:3 | |
| B. | N2是氧化产物,且还原剂与氧化剂物质的量之比是2:3 | |
| C. | 每转移6mol电子就生成22.4LN2 | |
| D. | NH4Cl是氧化产物,且还原剂与氧化剂物质的量之比是2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,
一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作及现象 | 结论 |
| A | 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 | 溶液中含有NH4+ |
| B | 将浓硝酸滴入碳酸钠溶液中,然后将生成的气体直接通入硅酸钠溶液中,溶液变浑浊. | 酸性:硝酸>碳酸>硅酸 |
| C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液,溶液变成蓝色 | 氧化性:I2>Cl2 |
| D | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 铜锌原电池(如图)工作时,以下说法正确的是( )
铜锌原电池(如图)工作时,以下说法正确的是( )| A. | ①②③ | B. | ②④⑤ | C. | ②③④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的两种氧化物中阴阳个数比均为1:2 | |
| B. | Y的氧化物熔点高,常用作耐高温材料 | |
| C. | Z的氧化物属于酸性氧化物,不能与任何酸反应 | |
| D. | R的同主族氢化物稳定性从上往下依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
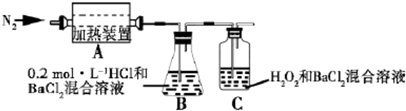
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
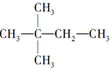 ,则A的结构简式为(CH3)3CCH=CH2.
,则A的结构简式为(CH3)3CCH=CH2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是国际单位制中七个基本物理量之一 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 摩尔可以把物质的宏观数量与微观粒子的数量联系起来 | |
| D. | 国际上规定,0.012 kg碳原子中所含有的碳原子数目为1摩 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com