
【题目】X、Y、Z、P、Q为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法正确的是

A. Q的氧化物一定含有离子键和共价键 B. 最高价含氧酸的酸性:Z<Y
C. P的最低价氢化物常温常压下为液体 D. Y形成的化合物种类最多
【答案】D
【解析】X、Y、Z、P、Q为五种短周期元素,X、Q最外层只有一个电子,为第IA族元素;Y最外层有4个电子,位于第IVA族,Z原子最外层有5个电子,位于第VA族,P最外层有6个电子,位于第VIA族;Q原子半径最大,为Na元素,X原子半径最小,为H元素;Y原子和Z原子半径接近、P原子半径大于Y而最外层电子数大于Y,所以Y是C、Z是N、P为S元素;A.Na的氧化物有氧化钠和过氧化钠两种,但不论是氧化钠还是过氧化钠,结构中均含离子键,但氧化钠中没有共价键,故A错误;B.元素的非金属性越强,其最高价含氧酸的酸性越强,非金属性Z>Y,所以其最高价含氧酸酸性Z>Y,故B错误;C.P的氢化物的硫化氢,常温下为气体,故C错误;D.Y为碳元素,而C元素形成的有机物种类繁多,远多于无机物的种类,故D正确;故选D。


 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.NO2与水的反应:3NO2+H2O═2NO3﹣+NO+2H+
B.氯气通入水中:Cl2+H2O═2H++Cl﹣+ClO﹣
C.向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH﹣ ![]() NH3↑+H2O
NH3↑+H2O
D.向硅酸钠溶液中通入SO2:SiO32﹣+2H+═H2SiO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列金属或氧化物可以完全溶解的是
A、1molZn与含1molHCl的稀盐酸共热
B、1molCu与含2molH2SO4的浓硫酸共热
C、1molCu与含4molHNO3的浓硝酸
D、1molMnO2与含4molHCl的浓盐酸共热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、下图表示一些晶体中的某些结构,它们分别是氯化钠、氯化铯、干冰、金刚石、石墨结构中的某一种的某一部分(黑点可表示不同或相同的粒子)。
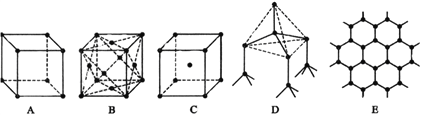
(1)其中代表金刚石的是_______(填编号字母,下同),金刚石中每个碳原子与_____个碳原子最接近且距离相等。
(2)其中代表石墨的是______,其中每个正六边形占有的碳原子数平均为____________个;
(3)其中表示氯化钠的是______,每个钠离子周围与它最接近且距离相等的钠离子有______个;
(4)代表氯化铯的是________,每个铯离子与________个氯离子紧邻;
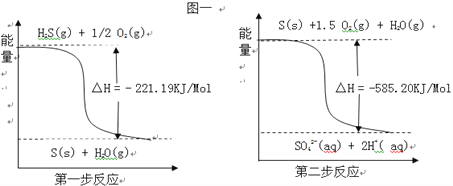
II、(1)已知14gCO气体在氧气中完全燃烧可放出141.5 kJ的热量,写出CO燃烧的热化学方程式______________________________________________;
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42﹣,两步反应的能量变化示意图如下:则1mol H2S(g)全部氧化成SO42﹣(aq)的热化学方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读明代爱国诗人于谦的诗《石灰吟》,回答问题: 千锤万凿出深山,烈火焚烧若等闲.粉身碎骨浑不怕,要留清白在人间
(1)整首诗蕴含着石灰的来源、生产、性质、用途等多种化学事实,诗中所描述的变化共涉及到下列物质:①石灰石(主要成分CaCO3)②CaO③CO2④H2O⑤Ca(OH)2悬浊液⑥CaCO3 , 其中属于电解质的是(填序号)
(2)下列工业生产中一般不用石灰石作为原料的是(填序号) ①用海水为原料生产镁 ②制硅酸盐水泥 ③制普通玻璃 ④制漂白粉⑤制陶瓷
(3)零食包装袋中经常有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰,生石灰属于氧化物(填“酸性”或“碱性”),用方程式说明你的理由 .
(4)某兴趣小组同学对碳酸钙的制备进行了以下探究,该组同学使用大理石(含少量的Fe2O3杂质)等物质制备碳酸钙的实验流程如图: 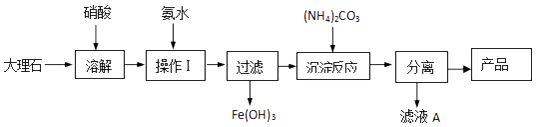 溶解大理石时,用硝酸而不用硫酸的原因是 , “滤液A”中除H+离子外,还含有的阳离子是;检验该阳离予的实验操作是 .
溶解大理石时,用硝酸而不用硫酸的原因是 , “滤液A”中除H+离子外,还含有的阳离子是;检验该阳离予的实验操作是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期元素,其原子序数依次增大。A原子的最外层电子数是次外层电子数的2倍,C的氢化物在常温下为液体,D能形成DF型离子化合物,0.9 g E与足量的稀硫酸反应生成的氢气在标准状况下的体积为1.12 L,F的族序数与周期序数之差为4。请回答下列问题:
(1)写出元素符号:A________;B________; F_________。
(2)六种元素中,单质还原性最强的是______(写化学式,下同);最高价氧化物对应水化物中酸性最强的酸是__________。
(3)写出C与D形成的原子个数比为1:1的化合物的电子式:______所含化学键类型为______。
(4)六种元素中的三种元素组成的某种盐的水溶液呈碱性,是家用消毒剂的主要成分,请用离子方程式解释该盐溶液呈碱性的原因:_____________。
(5)D、E元素的最高价氧化物对应的水化物发生反应的离子方程式为_________。
(6)写出用惰性电极电解饱和DF溶液的化学方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 合金一定是金属熔合而成的物质
B. 利用丁达尔效应可以鉴别Fe(OH)3胶体和FeCl3溶液
C. 当大量氯气泄漏时,用NaOH溶液浸湿毛巾捂住嘴和鼻子,并迅速离开现场
D. 实验室常将氢氟酸保存在细口玻璃瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向两个体积可变的密闭容器中均充入1mol的A 和2 mol 的B,发生反应:A2(g)+2B2(g)![]() 2AB2(g) △H。维持两个容器的压强分别为p1和p2,在不同温度下达到平衡,测得平衡时AB2的体积分数随温度的变化如图所示。
2AB2(g) △H。维持两个容器的压强分别为p1和p2,在不同温度下达到平衡,测得平衡时AB2的体积分数随温度的变化如图所示。
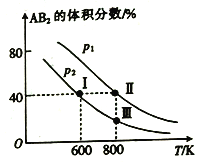
已知: ①图中I、Ⅱ、Ⅲ点均处于曲线上;②点Ⅱ时容器的体积为0.1L。下列叙述正确的是
A. 由图像可知:p1>p2 △H<0
B. 点I时A2的平衡转化率为40%
C. 点Ⅲ所对应的反应平衡常数K=0.2
D. 将点Ⅱ所对应的容器冷却到600 K,可变成点I
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去空气中的二氧化硫和氨氧化物气体对环境保护有重要意义。
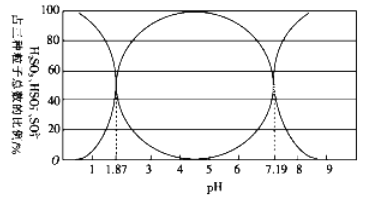
(1)二氧化硫易溶于水,溶于水后所得溶液中H2SO3、HSO3-和SO32- 占三种粒子总数的比例随pH的变化如下图所示。由图可知H2SO3 的电离平衡常数Ka1=____________。
(2)利用尿素[CO(NH2)2]水解的溶液可以吸收含SO2 的空气。已知尿素水解放热,常温下水解反应较慢,水解的反应方程式如下:CO(NH2)2+H2O=H2NCOONH4(氨基甲酸铵)。
①氨基甲酸铵会与空气中的SO2 和O2 反应生成(NH4)2SO4,该反应的化学方程式为__________。
②一定条件下,用尿素溶液吸收含SO2 的空气,测得SO2 的吸收率随溶液的温度变化如图甲所示。温度高于60 ℃时,SO2 的吸收率逐渐升高的原因是_____________。
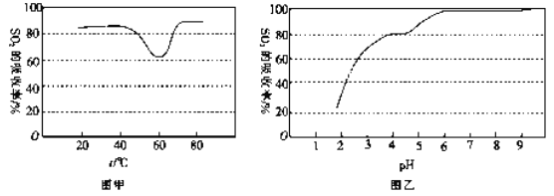
③尿素溶液吸收SO2 的吸收率随溶液的pH变化如图乙所示。尿素溶液吸收含SO2的空气后溶液的pH会降低,为提高SO2 的吸收率和充分回收产物,最好向溶液中加入_____(填溶液的名称)并控制pH 为_______。
(3)一种电化学脱硝法的原理如图所示。
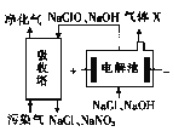
①电解池阴极所发生的电极反应为_____________。
②相同条件下通入的污染气和生成的X 的体积比为40 :3,污染气中NO 和NO2 占总体积的10%,若NaClO完全反应,污染气中NO和NO2 被完全吸收且其余气体不参与反应,则NO和NO2 的体积比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com