
分析 (1)在原子中,核电荷数=质子数=核外电子数,质量数=质子数+中子数;
(2)在阳离子中,核电荷数=质子数=核外电子数+所带电荷数;
(3)在阴离子中,核电荷数=质子数=核外电子数-所带电荷数;
(4)在原子中,核电荷数=质子数=核外电子数,分子的电子数等于原子的电子数之和;
(5)元素A的质量数为m,A2-离子的原子核内有x个中子,则A的质子数为m-x,所以A2-中核外电子数为m-x+2,计算出n克A2-离子的物质的量,则可计算电子个数.
解答 解:(1)根据在原子中:质量数=质子数+中子数,所以中子数=质量数-质子数,故答案为:A-Z;
(2)根据在阳离子中:核电荷数=质子数=核外电子数+所带电荷数,即核电荷数=质子数=x+n,又根据质量数=质子数+中子数,即中子数=质量数-质子数=A-(x+n),故答案为:A-x-n;
(3)根据在阴离子中:核电荷数=质子数=核外电子数-所带电荷数,即核电荷数=质子数=x-n,又根据质量数=质子数+中子数,即中子数=质量数-质子数=A-(x-n),故答案为:A-x+n;
(4)根据12C中核电荷数=质子数=核外电子数=6,再根据18O中核电荷数=质子数=核外电子数=8,所以12C18O2分子中,电子数为6+8×2=22,
故答案为:22;
(5)元素A的质量数为m,A2-离子的原子核内有x个中子,则A的质子数为m-x,所以A2-中核外电子数为m-x+2,
n(A2-)=$\frac{n}{m}$mol,
则n克A2-离子中包含电子个数是$\frac{n}{m}$mol×(m-x+2)×NA/mol=$\frac{n}{m}$(m-x+2)mol;
故答案为:$\frac{n}{m}$(m-x+2)mol.
点评 本题考查了原子的构成、物质的量的相关计算,侧重于学生的分析能力和计算能力的考查,注意把握原子结构特点以及相关计算公式的运用,难度不大.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 铝和氢氧化钠溶液反应:2Al+2OH-=2AlO2-+H2↑ | |
| B. | 铜与足量FeCl3溶液反应:Fe3++Cu=Fe2++Cu2+ | |
| C. | 用醋酸除去水瓶中的水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| D. | 向苯酚钠溶液中通入CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 的名称为2-甲基-2,4-己二烯.
的名称为2-甲基-2,4-己二烯. 该物质所含官能团的名称分别为羟基、酯基、羧基.
该物质所含官能团的名称分别为羟基、酯基、羧基. 进行一氯取代反应后,只能生成3种沸点不同产物.
进行一氯取代反应后,只能生成3种沸点不同产物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氘(D)原子核外有1个电子 | |
| B. | 1H218O与D216O的相对分子质量相同 | |
| C. | H2O与D2O互称同素异形体 | |
| D. | 1H与D互称同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$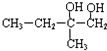 +2NaBr,反应类型是取代反应.
+2NaBr,反应类型是取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ(A)=0.5 mol•(L•s)-1 | B. | υ(B)=0.3 mol•(L•s)-1 | ||
| C. | υ(C)=0.8 mol•(L•s)-1 | D. | υ(D)=1 mol•(L•s)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 陈述Ⅰ | 陈述Ⅱ | |
| A | NaHCO3为强碱弱酸盐,只存在水解平衡 | NaHCO3溶液显碱性 |
| B | HCL与Na2CO3溶液反应生成CO2 | 用饱和NaCO3溶液除去CO2中的少量HCl |
| C | Cl2使润湿的有色布条褪色,而干燥的布条不褪色 | 次氯酸的氧化性比氯气的强 |
| D | 常温下铁、铜均不溶于浓硫酸 | 常温下铁、铜与浓硫酸均不反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500mL1mol/L的KNO3溶液 | B. | 500mL1mol/L的Ba(NO3)2溶液 | ||
| C. | 100mL0.5mol/L的Mg(NO3)2溶液 | D. | 1L0.5mol/L的Fe(NO3)3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com