
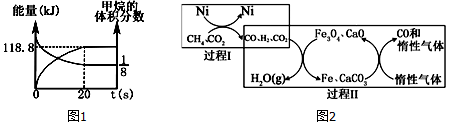
分析 (4)过程Ⅱ,实现了含氢物种与含碳物种的分离.生成H2O,反应物为氢气和四氧化三铁,生成物为铁和水;
(5)a.氧化还原反应的特征是元素化合价的升降,根据过程Ⅰ和过程Ⅱ发生的反应判断;
b.催化剂参与化学反应,但在反应前后质量和化学性质保持不变;
c.过程Ⅱ中催化剂为CaO,若过程I投料$\frac{n(C{H}_{4})}{n(C{O}_{2})}$=1,与催化剂反应的二氧化碳不存在,催化剂失效;
(6)20秒时,达到平衡,甲烷的体积分数为$\frac{1}{8}$,能量变化为118.8KJ,根据三段式计算△H.
解答 解:(4)过程I:CH4+CO2(g)$\stackrel{Ni}{?}$2H2(g)+2CO,过程Ⅱ:实现了含氢物种与含碳物种的分离,氢气和四氧化三铁反应:4H2+Fe3O4$\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4H2O,
故答案为:4H2+Fe3O4$\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4H2O;
(5)a.过程I:CH4+CO2(g)$\stackrel{Ni}{?}$2H2(g)+2CO,碳、氢元素化合价发生变化,属于氧化还原反应,过程Ⅱ:4H2+Fe3O4$\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4H2O,氢、铁元素化合价发生变化,属于氧化还原反应,过程I和过程Ⅱ中均含有氧化还原反应,故a正确;
b.过程Ⅱ中使用的Fe3O4 为反应物,不属于催化剂,故b错误;
c.若过程I投料$\frac{n(C{H}_{4})}{n(C{O}_{2})}$=1,CH4+CO2(g)$\stackrel{Ni}{?}$2H2(g)+2CO,催化剂CaO在过程Ⅱ中没有二氧化碳与之反应,催化剂失效,故c正确;
故答案为:a c;
(6)由图可知:20秒时,达到平衡,甲烷的体积分数为$\frac{1}{8}$,能量变化为118.8KJ,设变化的甲烷物质的量为x,
CH4(g)+3CO2(g)?2H2O(g)+4CO(g)
始(mol ) 1.2 4.8
变(mol ) x 3x 2x 4x
终(mol )1.2-x 4.8-3x 2x 4x
$\frac{1.2-x}{1.2-x+4.8-3x+2x+4x}$=$\frac{1}{8}$,解得x=0.36,0.36mol CH4(g)参加反应能量变化为118.8KJ,则1mol CH4(g)能量变化为330 kJ,则CH4(g)+3CO2(g)?2H2O(g)+4CO(g)△H>0,△H=+330 kJ/mol,
故答案为:+330 kJ/mol.
点评 本题考查了利用甲烷超干重整CO2技术,侧重考查了化学平衡有关知识,注意催化剂的特征,注意读图,(6)为该题的难点,试题总体难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 铵态氮肥和草木灰混合使用可增加肥效 | |
| B. | 氢氟酸刻蚀水晶饰品体现其酸性 | |
| C. | 电渗析法、蒸馏法、离子交换法是海水淡化的常用方法 | |
| D. | 煤经过气化和液化等物理变化可转为清洁能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
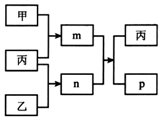 短周期主族元素X、Y、Z、W的原子序数依次增大.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙易溶于YW2,n为二元弱酸.上述物质的转化关系如图所示(反应条件省略).下列说法一定正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙易溶于YW2,n为二元弱酸.上述物质的转化关系如图所示(反应条件省略).下列说法一定正确的是( )| A. | 原子半径:X<Y<Z | |
| B. | 最简单氢化物的沸点:Z>W>Y | |
| C. | W的氧化物的水化物为强酸 | |
| D. | 常温常压下,X与Y组成的化合物为气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时正极上的电极反应为:V2O4+xe-+xLi+=LixV2O4 | |
| B. | 该充电宝的凝胶介质也可用KOH溶液代替 | |
| C. | 充电时电池的正极得到电子后LixV2O4转化为V2O4 | |
| D. | 放电时每消耗7gLi,就会有1mol电子通过凝胶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 电解质溶液电导率越大导电能力越强.常温下用0.100mol•L-1盐酸分别滴定10.00mL浓度均为0.100•L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温下Kb[(CH3)2NH•H2O=1.6×10-4).利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )
电解质溶液电导率越大导电能力越强.常温下用0.100mol•L-1盐酸分别滴定10.00mL浓度均为0.100•L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温下Kb[(CH3)2NH•H2O=1.6×10-4).利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )| A. | 曲线①代表滴定二甲胺溶液的曲线 | |
| B. | a点溶液与d点的溶液混合后的溶液中:c[(CH3)2NH2+)]<c[(CH3)2NH•H2O] | |
| C. | d点溶液中:c(H+)=c(OH-)+c[(CH3)2NH•H2O] | |
| D. | b、c、e三点的溶液中,水的电离程度最大的是b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
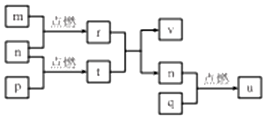 短周期主族元素 X、Y、Z、W的原子序数依次增大,四种元素形成的单质依次为m、n、p、q;r、t、u 是这些元素组成的二元化合物,其中u为葡萄酒中的抑菌成分;25℃,0.01mol/L的v溶液中:$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示,下列说法不正确的是( )
短周期主族元素 X、Y、Z、W的原子序数依次增大,四种元素形成的单质依次为m、n、p、q;r、t、u 是这些元素组成的二元化合物,其中u为葡萄酒中的抑菌成分;25℃,0.01mol/L的v溶液中:$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示,下列说法不正确的是( )| A. | 简单离子半径:W>Y>Z>X | |
| B. | W,Y分別与X元素形成的简单化合物的沸点:Y>W | |
| C. | Z2Y和ZX都只存在离子键 | |
| D. | v能抑制水的电离,u的水溶液能促进水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m、n、q一定是非金属元素 | |
| B. | 氢化物的沸点:q>n>m | |
| C. | 离子半径的大小:q>n>p | |
| D. | m与q形成的二元化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应必然伴随发生能量变化 | |
| B. | 化学反应中的能量变化主要是由化学键变化引起的 | |
| C. | 反应物的总能量与生成物的总能量一定相等 | |
| D. | 化学反应中既有物质变化又有能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com