
| A. | 铁表面镀锌可增强其抗腐蚀性 | |
| B. | 人造纤维、合成纤维和光导纤维都是新型无机非金属材料 | |
| C. | 氢氧化铝可用于制作治疗胃酸过多的药物 | |
| D. | “煤改气”、“煤改电”等改造工程有利于减少雾霾天气 |
分析 A.锌比铁活泼,并且在空气中容易形成致密的氧化膜,防止生锈;
B.合成纤维是有机非金属材料,光导纤维是新型无机非金属材料;
C.氢氧化铝为难溶物,能够中和胃酸中的盐酸;
D.从雾霾天气的成因考虑.
解答 解:A.锌比铁活泼,并且在空气中容易形成致密的氧化膜,防止生锈,故A正确;
B.合成纤维是有机非金属材料,光导纤维是新型无机非金属材料,故B错误;
C.氢氧化铝能够与胃酸中的盐酸反应,能够作胃酸的中和剂,故C正确;
D.二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,前两者为气态污染物,最后一项颗粒物才是加重雾霾天气污染的罪魁祸首.它们与雾气结合在一起,让天空瞬间变得灰蒙蒙的,“煤改气”、“煤改电”等清洁燃料改造工程减少了二氧化硫、氮氧化物和可吸入颗粒物,故有利于减少雾霾天气,故D正确;
故选B.
点评 本题考查了常见生活环境的污染与治理、金属的腐蚀与防护等问题,难度一般.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 该溶液可能由pH=3盐酸与pH=11的NH3•H2O溶液等体积混合而成 | |
| B. | 该溶液可能由等物质的量浓度的NH3•H2O与盐酸以2:1的体积比混合 | |
| C. | 该溶液中由水电离出的氢离子浓度一定大于1.0×10-7mol•L-1 | |
| D. | 加入一定量NH3•H2O,c(NH4+)可能大于、等于或小于c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟原子的结构示意图: | |
| B. | 邻硝基甲苯的结构简式: | |
| C. | 质子数为27、中子数为33的Co原子:${\;}_{27}^{60}$Co | |
| D. | H2O2的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用白醋除铁锈:Fe2O3•xH2O+6H+═(3+x)H2O+2Fe3+ | |
| B. | 向Ba(OH)2溶液中加入少量的NH4HSO4溶液:Ba2++2OH-+N${{H}_{4}}^{+}$+H++S${{O}_{4}}^{2-}$═BaSO4↓+NH3•H2O+H2O | |
| C. | 纯碱溶液和苯酚反应:C${{O}_{3}}^{2-}$+2C6H5OH→2C6H5O-+CO2↑+H2O | |
| D. | 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
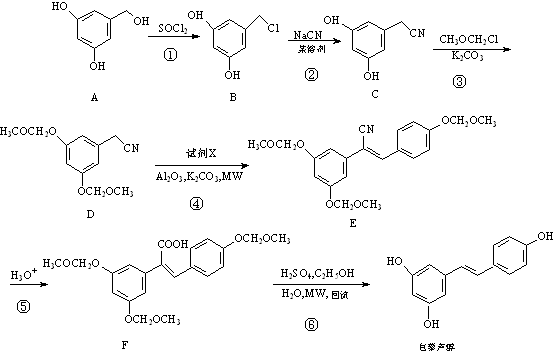
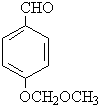 .
.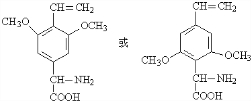 (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
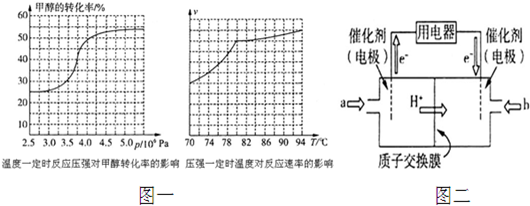
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质在空气中完全燃烧转化为水和二氧化碳 | |
| B. | 汽油、甘油、花生油都属于酯类物质 | |
| C. | 麦芽糖及其水解产物均能发生银镜反应 | |
| D. | 燃煤产生的二氧化硫是引起雾霾的主要原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化铝溶液中滴加过量氨水,生成白色胶状沉淀:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 加入足量的氢氧化镁以除去氯化镁溶液中的少量氯化铁:Fe3++3OH-═Fe(OH)3↓ | |
| C. | 常温下0.1mol/L 氯化铵溶液pH=5:NH4++H2O?NH3•H2O+H+ | |
| D. | 电解精炼铜时阳极铜溶解:Cu-2e-═Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
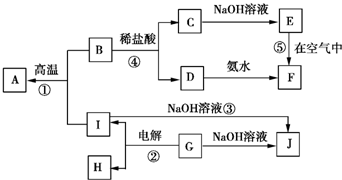 A~I分别表示中学化学中常见的一种物质,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且A、B、C、D、E、F六种物质中均含同一种元素.
A~I分别表示中学化学中常见的一种物质,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且A、B、C、D、E、F六种物质中均含同一种元素.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com