
| A. | Na2CO3是强电解质,BaCO3是弱电解质 | |
| B. | c(H+)=1×10-7mol•L-1的溶液一定呈中性 | |
| C. | 将硫酸铝和氯化铝溶液分别加热蒸干后灼烧,得到的固体都是氧化铝 | |
| D. | 将0.1 mol•L-1醋酸溶液加水稀释时,电离能力增强,但c(H+)变小 |
分析 A.碳酸盐均为强电解质;
B.100℃时,纯水中氢离子浓度大于1×10-7mol•L-1;
C.硫酸铝加热蒸干,仍然得到硫酸铝;
D.稀释酸性溶液,溶液中氢离子浓度减小.
解答 解:A、NaHCO3和BaCO3均属于盐,是强电解质,故A错误;
B、(H+)=10-7mol•L-1的溶液,溶液的pH=7,若温度为100℃,纯水中氢离子浓度大于1×10-7mol•L-1,此时的溶液呈碱性,故B错误;
C、氯化铝为强酸弱碱盐,水解出Al(OH)3和HCl:AlCl3+3H2O?Al(OH)3+HCl,而HCl是挥发性酸,受热挥发会导致水解平衡右移,导致AlCl3彻底水解为Al(OH)3,灼烧时Al(OH)3又会分解为Al2O3,故将氯化铝溶液蒸干并灼烧得到的固体物质是Al2O3;Al2(SO4)3是强酸弱碱盐,水解出H2SO4和Al(OH)3,而H2SO4是不挥发性酸,受热不能挥发,即Al2(SO4)3的水解不能彻底,故最终得到的即为Al2(SO4)3,故C错误;
D、将0.1 mol•L-1醋酸溶液加水稀释时,促进醋酸的电离,电离能力增强,由于溶液的体积变化大于氢离子的物质的量变化,所以c(H+)变小,故D正确,
故选D.
点评 本题考查了强弱电解质的判断、影响水的电离的因素、盐类水解的应用等,题目难度不大,注意相关知识的积累,侧重于考查学生对基础知识的应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 反应CO2(g)+C(s)=2CO(g)在高温下可自发进行,则该反应的△H>0 | |
| B. | 工业上电解饱和食盐水时,以石墨作阴极,铁棒作阳极 | |
| C. | 常温下,0.1mol•L-1 CH3COOH溶液pH=1 | |
| D. | 常温下,在AgCl悬浊液中加入少量NaCl饱和溶液,c(Ag+)减小,Ksp(AgCl) 减小和溶液的pH均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH[来: | 13 | 14 | 3.7 |
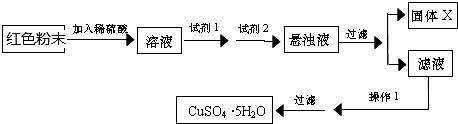
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH+OH-═CH3COO-+H2O | B. | H++OH-═H2O | ||
| C. | CH3COOH+OH-+Na+═CH3COONa+H2O | D. | CH3COOH+NaOH═CH3COO-+Na++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
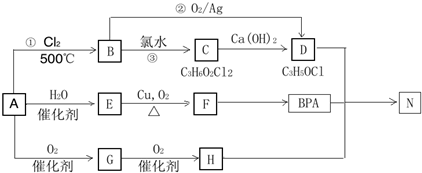

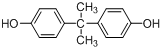
 .
.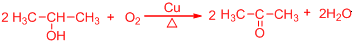 .
.
 .
.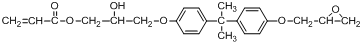
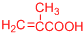 (或
(或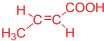 、
、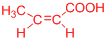 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
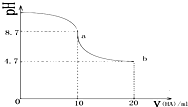
| A. | a点所示溶液中有c(Na+)>c(A-)>c(HA)>c(H+) | |
| B. | a、b两点曲线之间某时刻的溶液中有c(Na+)=c(A-) | |
| C. | a、b两点所示溶液中水的电离程度相同 | |
| D. | b点所示溶液中有 2c(Na+)=c(A-)+c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定容时俯视刻度线 | |
| B. | 容量瓶中原有少量蒸馏水 | |
| C. | 定容时液面高于刻度,用滴管小心吸去多余溶液,使液面与刻度相切 | |
| D. | 称取Na2CO3固体时,采用了“左码右物” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮化硼(BN)是新型无机非金属材料,可作润滑剂、高级耐火材料和超硬材料等,某兴趣小组以下装置用NH3与B2O3固体在高温下制备少量氮化硼.
氮化硼(BN)是新型无机非金属材料,可作润滑剂、高级耐火材料和超硬材料等,某兴趣小组以下装置用NH3与B2O3固体在高温下制备少量氮化硼.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com