

(一)实验目的:研究铁与浓硫酸的反应
(二)实验药品:铁钉、浓硫酸、酸性高锰酸钾溶液、品红溶液、氧化铜、硫酸铜溶液
(三)实验步骤

(四)问题探究:
该学生在实验过程中,观察到D装置中溶液颜色逐渐变浅,E装置中溶液颜色未见明显变化,再过一段时间后,G装置中氧化铜粉末由黑色转变为红色。气球H逐渐鼓起,此时E装置中溶液颜色仍未明显变化。
(1)G装置中氧化铜由黑变红,请结合化学方程式说明原因是______________。
(2)为证明铁钉与浓硫酸在不加热时是否发生化学反应,可采用的方法是__________。
(三)②原因:铁遇冷的浓硫酸发生钝化
③原因:铁表面的氧化膜被破坏并发生反应,溶液中有Fe3+生成,并伴随有SO2气体产生
(四)(1)A装置中浓硫酸在加热的条件下与铁反应逐渐变为稀硫酸,发生Fe+H2SO4![]() FeSO4+H2↑,生成的H2经过G装置中发生CuO+H2
FeSO4+H2↑,生成的H2经过G装置中发生CuO+H2![]() Cu+H2O,所以氧化铜由黑变红
Cu+H2O,所以氧化铜由黑变红
(2)将铁钉放置在冷的浓硫酸浸泡一段时间后,取出铁钉置于硫酸铜溶液中,观察铁钉表面是否有红色物质析出:若没有红色物质析出,则表明在不加热时,铁钉与浓硫酸发生反应,否则铁钉与浓硫酸不发生反应
解析:(三)两个原因按教材上的结论回答:常温下,铁遇冷浓H2SO4钝化,加热时,“解钝”——氧化膜破坏。
(四)(1)依据题干信息可知:在E中SO2被吸收完全,而H逐渐鼓起,且黑色CuO变红色,说明产生另外一种还原性的气体只能是H2,推测是因H2SO4变稀的缘故。
(2)若铁与浓H2SO4未反应,则将Fe与CuSO4溶液作用,将会发生:Fe+CuSO4![]() Cu+FeSO4,则铁表面有铜析出;若铁与浓H2SO4反应了,则铁钉表面覆盖一层氧化膜,与CuSO4溶液作用,不会发生什么变化。
Cu+FeSO4,则铁表面有铜析出;若铁与浓H2SO4反应了,则铁钉表面覆盖一层氧化膜,与CuSO4溶液作用,不会发生什么变化。


科目:高中化学 来源:广东省高州一中2009-2010学年高一学科竞赛化学试题 题型:058
某学生按图示方向将A装置与下面所示装置相连,设计如下实验,请帮助完成实验报告.
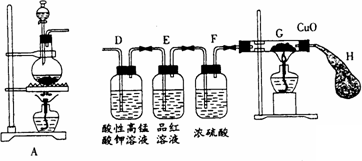
(一)实验目的:研究铁与浓硫酸的反应
(二)实验药品:铁钉、浓硫酸、酸性高锰酸钾溶液、品红溶液、氧化铜、硫酸铜溶液
(三)实验步骤(将原因填入表中)
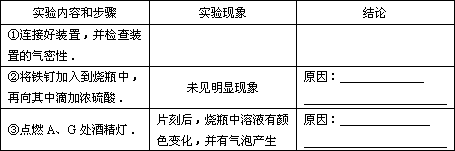
(四)问题探究:
该学生在实验过程中,观察到D装置中溶液颜色逐渐变浅,E装置中溶液颜色未见明显变化,再过一段时间后,G装置中氧化铜粉末由黑色转变为红色,气球H逐渐鼓起,此时E装置中溶液颜色仍未明显变化.
(1)G装置中氧化铜由黑变红,请结合化学方程式说明原因________________.
(2)为证明铁钉与浓硫酸在不加热时是否发生反应,可采用的方法是__________.
查看答案和解析>>
科目:高中化学 来源:2006-2007广东省学年高三第一次模拟考试化学卷 题型:058
| |||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com