
【题目】钒液流电池充电时间短,续航能力强,其充放电原理为VO2+(蓝色)+V3+(绿色)+H2O ![]() VO2+(黄色)+V2+(紫色)+2H+。以此电池为电源,用石墨电极电解Na2SO3溶液,可得到NaOH 和H2SO4示意图如下。下列说法错误的是( )
VO2+(黄色)+V2+(紫色)+2H+。以此电池为电源,用石墨电极电解Na2SO3溶液,可得到NaOH 和H2SO4示意图如下。下列说法错误的是( )
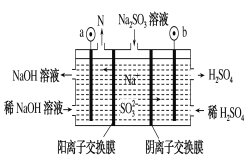
A. 全钒液流电池放电时,正极的电极反应式为: VO2++2H++e-===VO2++H2O
B. 图中a电极为阴极,N物质是H2
C. 钒液流电池充电时,阳极附近溶液由绿色逐渐变为紫色
D. 电解时,b电极的反应式为: SO32-+H2O-2e-===SO42-+2H+
【答案】C
【解析】
由VO2+(蓝色)+V3+(绿色)+H2O ![]() VO2+(黄色)+V2+(紫色)+2H+,可知,放电时,V2+(紫色)在负极失去电子生成V3+(绿色),VO2+(黄色)在正极上得到电子生成VO2+(蓝色),原电池中阳离子向正极移动;充电时阴极发生还原反应,与原电池负极相连,用石墨电极电解Na2SO3溶液,可得到NaOH和H2SO4。在阳极上是亚硫酸根和氢氧根离子失电子,氢离子浓度增大,硫酸根移向该电极,产生硫酸;在阴极上是氢离子得电子的还原反应,氢氧根离子浓度增加,钠离子移向该电极,产生氢氧化钠,据此分析解答。
VO2+(黄色)+V2+(紫色)+2H+,可知,放电时,V2+(紫色)在负极失去电子生成V3+(绿色),VO2+(黄色)在正极上得到电子生成VO2+(蓝色),原电池中阳离子向正极移动;充电时阴极发生还原反应,与原电池负极相连,用石墨电极电解Na2SO3溶液,可得到NaOH和H2SO4。在阳极上是亚硫酸根和氢氧根离子失电子,氢离子浓度增大,硫酸根移向该电极,产生硫酸;在阴极上是氢离子得电子的还原反应,氢氧根离子浓度增加,钠离子移向该电极,产生氢氧化钠,据此分析解答。
A、全钒液流电池放电时,VO2+在正极上得到电子,正极的电极反应式为VO2++2H++e-=VO2++H2O,故A正确;
B、在阴极上是氢离子得电子的还原反应,氢氧根离子浓度增加,钠离子移向该电极,会产生氢氧化钠,a电极为阴极,N物质是H2,故B正确;
C、钒液流电池充电时,VO2+(蓝色)被氧化为VO2+(黄色),故C错误;
D、电解时,b电极是阳极,该电极的反应式为SO32-+H2O-2e-=SO42-+2H+,故D正确;
答案选C。


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
【题目】测定有机化合物中碳和氢的组成常用燃烧分析法,下图是德国化学家李比希测定有机物组成的装置,氧化铜作催化剂,在750℃左右使有机物在氧气流中全部氧化为CO2和H2O,用含有固体氢氧化钠和氯化钙的吸收管分别吸收CO2和H2O。
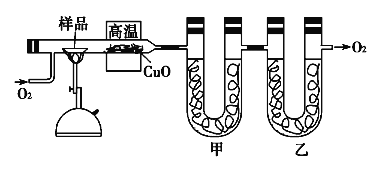
试回答下列问题:
(1)甲装置中盛放的是________,甲、乙中的吸收剂能否颠倒?________。
(2)实验开始时,要先通入氧气一会儿,然后再加热,为什么? _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应的离子方程式书写正确的是

A. OH+HCl=H2O+ClB. Ca(OH)2+Cu2+=Ca2++Cu(OH)2
C. Fe+Cu2+=Cu+Fe2+D. Fe+2H+=Fe3++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,B和酸性气体D反应能生成C,A露置在空气中足够长时间也会变为C,E与D反应也能生成C,A、B都能与水反应生成E。回答下列问题:
(1)写出下列物质的化学式: B________,C________,D________,E________。
(2)写出下列反应的化学方程式:
①A生成B:____________________;
②B与水反应生成E:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种中学常见的物质转化如图所示。
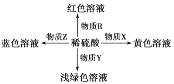
下表中R、X、Y、Z对应物质正确的是( )
选项 | R | X | Y | Z |
A | 紫色石蕊 | Fe2O3 | Fe2O3和Cu | Cu |
B | 甲基橙 | Fe(NO3)2 | Fe(OH)2 | Cu2(OH)2CO3 |
C | 酚酞 | Fe(OH)3 | FeO和Fe | CuO |
D | Fe2O3 | Na[Al(OH)4] | Na2SiO3 | Cu(OH)2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为验证卤素单质氧化性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
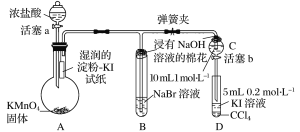
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ. ……
(1)盛放浓盐酸的仪器名称为____________________。
(2)在烧瓶内发生反应时,体现浓盐酸的性质为__________________。
(3)验证氯气的氧化性强于碘的实验现象是__________________________。
(4)B中溶液发生反应的离子方程式是____________________________。
(5)浸有NaOH溶液的棉花的作用为______________________________。
(6)为验证溴的氧化性强于碘,过程Ⅳ的操作步骤和现象是______________。
(7)过程Ⅲ实验的目的是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡酸钠可用于制造陶瓷电容器的基体、颜料和催化剂。以锡锑渣(主要含Sn、Sb、As、Pb的氧化物)为原料,制备锡酸钠的工艺流程图如下图所示:
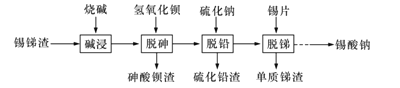
请回答下列问題:
(1)Sn(IVA)、As(VA)、Sb(VA)三种元素中,Sn的原子序数为50,其原子结构示意图为_____,碱浸”时SnO2发生反应的化学方程式为___________________________。
(2)“碱浸”时,若Sn元素氧化物中SnO含量较高,工业上则加入NaNO3,其作用是_______。
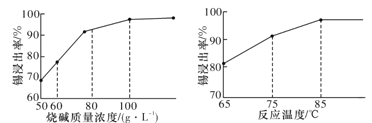
(3)从溶液中得到锡酸钠晶体的实验操作是_________、趁热过滤、洗涤、干燥。下图是“碱浸”实验的参数,请选择“碱浸”的合适条件_______。
(4)“脱铅”是从含Na2PbO2的溶液中形成硫化铅渣,其离子方程式为_________________。
(5)“脱锑”时Na2SbO4发生的化学方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂锰电池结构如图所示,其中电解质![]() 溶于混合有机溶剂中,
溶于混合有机溶剂中,![]() 通过电解质迁移入
通过电解质迁移入![]() 晶格中生成
晶格中生成![]() 。下列有关说法正确的是
。下列有关说法正确的是
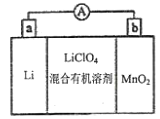
A. 外电路电流方向:a→b
B. 电池正极反应式为:![]()
C. 可以用水代替电池中的混合有机溶剂
D. 用该电池给铅蓄电池充电,a极与Pb电极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍及其化合物的应用正日益被重视。
(1)最重要的含铍矿物是绿柱石,含2%铬(Cr)的绿柱石即为祖母绿。基态Cr原子价电子的排布图为_______。
(2)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有_____(填字母)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液pH均小于7
(3)铍、铝晶体都是由金属原子密置层在三维空间堆积而成(最密堆积)。铍的熔点(1551K)比铝的熔点(930K)高,原因是____。
(4)氯化铍在气态时存在BeCl2分子(a)和二聚分子(BeCl2)2(b),固态时则具有如下图所示的链状结构(c)。
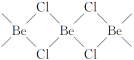
①a属于____(填“极性”或“非极性”)分子。
②二聚分子(BeCl2)2中Be原子的杂化方式相同,且所有原子都在同一平面上。b的结构式为____(标出配位键)。
(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所:
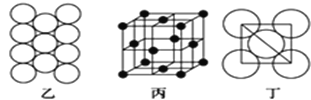
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为___个;Al晶体的密度为_____(用字母表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com