
 (对苯醌)═N2H4+
(对苯醌)═N2H4+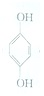 (对苯酚),N2H4的结构式为
(对苯酚),N2H4的结构式为 ,该电池正极的电极反应式为
,该电池正极的电极反应式为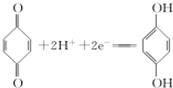 .
.| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
分析 (1)肼相当于氨气分子中一个氢原子被氨基取代;该电池正极上 得到电子生成
得到电子生成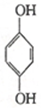 ;
;
(2)①根据电荷守恒及c(Cl-)=c(NH4+)判断溶液中氢离子浓度和氢氧根离子浓度相对大小,从而确定溶液的酸碱性,得出正确结论;
②根据电荷守恒及c(Cl-)<c(NH4+)判断溶液中氢离子浓度和氢氧根离子浓度相对大小,从而确定溶液的酸碱性,得出正确结论;
(3)①根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,书写平衡常数表达式,分析平衡常数随温度变化,结合平衡移动原理分析反应热量变化情况;
②依据浓度商和平衡常数的比较,判断反应进行的方向;
(4)①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1,
利用盖斯定律进行计算,由①+2×②得出正确结论.
解答 解:(1)肼中相当于氨气分子中一个氢原子被氨基取代,所以肼的结构式为 ;
;
该电池正极上 得到电子生成
得到电子生成 ,电极反应式为:
,电极反应式为: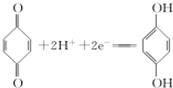 ,
,
故答案为: ;
;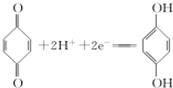 ;
;
(2)①根据电荷守恒得:c(Cl-)+c(OH-)=c(NH4+)+c(H+),溶液中c(Cl-)=c(NH4+),所以c(OH-)=c(H+),所以溶液呈中性,即pH=7,
故答案为:7;
②根据电荷守恒得:c(NH4+)+c(H+)=c(OH-)+c(Cl-),当c(NH4+)>c(Cl-)时,则c(H+)<c(OH-),溶液呈碱性;
a.盐酸不足,氨水剩余,溶液显碱性,与题意相符,故a可选;
b.氨水与盐酸恰好反应,生成氯化铵,铵根离子水解显酸性,与题意不符,故b不选;
c.盐酸过量,溶液呈酸性,与题意不符,故c不选;
故答案为:a;
(3)①N2(g)+3H2(g)?2NH3(g)△H=bkJ•mol-1,平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$,
由表中数据可知:平衡常数随温度升高而减小,说明升高温度,平衡逆向进行,逆向是吸热反应,故正反应为放热反应,故b小于0,
故答案为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$;小于;
②400°C N2(g)+3H2(g)?2NH3(g)的K=0.5,400℃时,测得氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,浓度分别为$\frac{3}{0.5}$=6mol/L,$\frac{2}{0.5}$=4mol/L,$\frac{1}{0.5}$=2mol/L,Qc=$\frac{{6}^{2}}{4×{2}^{3}}$=1.1>K,说明平衡逆向进行,v正(N2)<v逆(N2);
故答案为:小于;
(4)①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1,
由①+2×②可得:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=(-1266.8kJ•mol-1)+(+180.5kJ•mol-1)=-905.8KJ/mol,
故答案为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8KJ/mol.
点评 本题考查的知识点较多,涉及结构式、电极反应式的书写,溶液中离子浓度大小的判断,平衡常数的计算和化学平衡移动原理,以及盖斯定律的应用,综合性较强,浓度较大.要注意掌握根据浓度商和平衡常数的比较,判断反应进行的方向,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 2.4g金属镁所含电子数目为0.2NA | |
| B. | 1 mol CH4所含质子数目为10NA | |
| C. | 标准状况下22.4 L H2O所含分子数目为NA | |
| D. | 18g NH4+所含电子数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 加热0.1 mol.L-l NaC1O溶液测其pH,pH小于9.7 | |
| B. | 0.lmo1.L-1Na2CO3溶液中,存在如下关系:c(OH-)-c(H+)=c(HCO3)+2c(H2CO3) | |
| C. | 根据上表数据得出四种酸电离平衡常数大小关系为:HF>HC1O>H2CO3(一级电离平衡常数) | |
| D. | pH=2的HF溶液与pH=12的NaOH溶液体积比1:1混合,则有c(Na+)=c(F-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LNa2CO3溶液中:2c(Na+)=c(HCO3-)+c(H2CO3)+c(C032-) | |
| B. | 向0.1mol/L氯化铵溶液中滴加浓盐酸可能有c(NH4+)=c(H+) | |
| C. | pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH>7 | |
| D. | 将0.2mol/LNaA溶液和某浓度的盐酸等体积混合所得中性溶液中:c(Na+)=c(A-)+c(Cl-)=0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:2c(Na+ )=3[c(HC2O4- )+c(C2O42-)+c(H2C2O4)] | |
| B. | pH=4.3的NaHC2O4溶液中:c(Na+ )>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| C. | 0.10mol•L-1NaHCO3溶液中:c(Na+ )+c(H+ )=c(OH- )+c(HCO3-)+c(CO32-) | |
| D. | 0.10mol•L-1 NaHCO3溶液加水稀释后,n(H+ )与n(OH- )的乘积不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在多电子的原子里,能量高的电子通常在离核近的区域内活动 | |
| B. | 核外电子总是先排在能量低的电子层上,例如只有排满了M层后才排N层 | |
| C. | 核外电子总是先排在能量低的电子层上 | |
| D. | 微粒的最外层只能是8个电子才稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
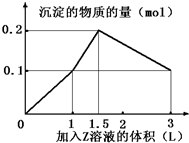 某混合溶液中,含溶质X、Y各0.1mol,向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如图,则符合条件的X、Y、Z分别是( )
某混合溶液中,含溶质X、Y各0.1mol,向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如图,则符合条件的X、Y、Z分别是( )| A. | 氯化铝、氯化铁、氢氧化钠 | B. | 氯化铝、氯化镁、氢氧化钠 | ||
| C. | 偏铝酸钠、氯化钡、硫酸 | D. | 偏铝酸钠、氢氧化钡、硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com