
| A.氯 | B.硫 | C.硅 | D.铝 |
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源:不详 题型:单选题
| A.1:3 | B.2:3 | C.1:1 | D.4:3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Na2SnS3+Na2SO4+2CO2↑。下列说法正确的是
Na2SnS3+Na2SO4+2CO2↑。下列说法正确的是| A.高温条件下SnO2的氧化性强于S | B.Na2SnS3是SnO2被氧化后的产物 |
| C.生成1mol Na2SnS3时转移6mol电子 | D.还原剂与氧化剂的质量比为3∶1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

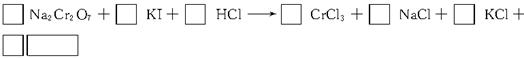
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 HSCN+HSCNO],它们阴离子的还原性强弱为:Cl-<Br-<SCN-<I-。试写出以下反应方程式:
HSCN+HSCNO],它们阴离子的还原性强弱为:Cl-<Br-<SCN-<I-。试写出以下反应方程式:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| △ |
| △ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com