
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 悬浊液 | 金属钠 | |
| X | 中和反应 | 无现象 | 溶解 | 产生氢气 |
| Y | 无现象 | 有银镜 | 加热后有砖红色沉淀 | 产生氢气 |
| Z | 水解反应 | 有银镜 | 加热后有砖红色沉淀 | 无现象 |
| W | 水解反应 | 无现象 | 无现象 | 无现象 |
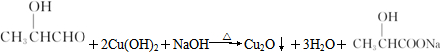 .
.分析 X能与NaOH发生中和反应且能溶解Cu(OH)2,说明含有-COOH;Y能发生银镜反应,说明含有-CHO,且能与Na发生生产氢气,说明含有-OH;Z能发生水解,且能发生银镜反应,说明含有-OOCH,为甲酸酯;W能水解,含有酯基,结合分子式可确定有机物的结构简式.
解答 解:分子式为C3H6O2的有机物X、Y、Z、W,它们的分子中均含甲基,由X能与NaOH发生中和反应且能溶解Cu(OH)2,说明含有-COOH,则X为CH3CH2COOH;Y能发生银镜反应,说明含有-CHO,能与Na发生生产氢气,说明含有-OH,Y为CH3CHOHCHO;Z能发生水解,且能发生银镜反应,说明含有-OOCH,为甲酸酯,即Z为HCOOCH2CH3,W能水解,含有酯基,W为CH3COOCH3,
(1)由上述分析可知,X、Y、Z、W分别为CH3CH2COOH、CH3CHOHCHO、HCOOCH2CH3、CH3COOCH3,
故答案为:CH3CH2COOH;CH3CHOHCHO;HCOOCH2CH3;CH3COOCH3;
(2)①Y与新制Cu(OH)2悬浊液反应的化学方程式为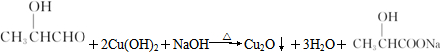 ,
,
故答案为: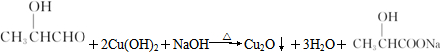 ;
;
②Z与NaOH溶液反应的化学方程式为HCOOCH2CH3+NaOH$\stackrel{△}{→}$HCOONa+CH3CH2OH,故答案为:HCOOCH2CH3+NaOH$\stackrel{△}{→}$HCOONa+CH3CH2OH.
点评 本题考查有机物的推断,为高频考点,把握官能团与性质的关系、有机反应与现象推断有机物为解答的关键,侧重分析与推断能力的考查,注意分子式相同均含甲基的信息应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 化学键 | C-Cl | C-Br |
| 键能9kJ•mol-1) | 330 | 276 |
| 化合物 | AgCl | AgBr |
| Ksp | 1.8×10-10 | 5×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | Z |
| R |
| A. | R的氧化物对应的水化物一定是强酸 | |
| B. | X、Y、Z三种元素既能形成共价化合物又能形成离子化合物 | |
| C. | 由X、Y、Z三种元素中的任意两种组成的具有10个电子的微粒有2种 | |
| D. | Z、W形成的化合物中只能含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
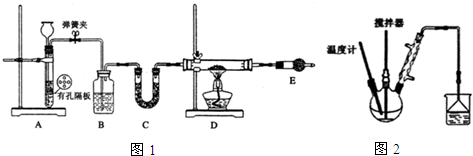
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OCH2CH2CH3 | B. | CH3CH(OH)CH2CH3 | C. | (CH3)2CHCH2OH | D. | CH3CH2CH2CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q与Y组成的常见物质是一种两性物质,结构中含有共价键 | |
| B. | 已知WRZQ3溶液呈酸性,若将WRZQ3固体溶于水,能促进水的电离 | |
| C. | 元素Q与W形成的两种常见化合物中含有相同比例的阴、阳离子 | |
| D. | 元素T、Q、W、Y的原子半径大小为T<Q<Y<W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
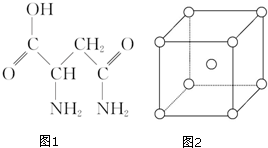 芦笋中的天冬酰胺(结构如图1)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.
芦笋中的天冬酰胺(结构如图1)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.| 化学式 | 键长/nm | 键角 |
| H2O | 0.99 | 104.5° |
| H2S | 1.34 | 92.3° |
| H2Se | 1.47 | 91.0° |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com