
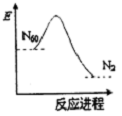
 最近科学家确认,存在着一种具有空心,且类似于足球结构的分子N60,N60转化N2的能量变化如图所示.下列说法正确的是( )
最近科学家确认,存在着一种具有空心,且类似于足球结构的分子N60,N60转化N2的能量变化如图所示.下列说法正确的是( )| A. | N60转化N2是物理变化 | B. | N2不如N60稳定 | ||
| C. | N60转化N2是吸收能量的过程 | D. | N60可能成为一种好的火箭材料 |
分析 A、N60和N2是2种不同的物质;
B、当反应物的能量高于生成物的能量,反应是放热,能量越高越不稳定;
C、当反应物的能量高于生成物的能量,反应是放热;
D、根据当反应物的能量高于生成物的能量,反应是放热分析.
解答 解:A、N60和N2是2种不同的物质,所以N60转化N2是化学变化,故A错误;
B、从图中看出:氮气能量低稳定,所以N2比N60稳定,故B错误;
C、从图中看出:反应物的能量高于生成物的能量,所以反应是放热的,所以N60转化N2是放热的过程,故C错误;
D、从图中看出:反应物的能量高于生成物的能量,所以反应是放热的,则N60可能成为一种好的火箭材料,故D正确.
故选D.
点评 本题涉及物质的能量和反应的吸放热之间的关系,注意能量越高越不稳定,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 纯银器表面在干燥空气中因电化学腐蚀渐渐变暗 | |
| B. | 在海轮外壳连接锌块是采用了牺牲阳极的阴极保护法 | |
| C. | 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 | |
| D. | 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y元素的基态原子核外原子排布式为1s22s22p2 | |
| B. | Y元素与Z元素可以形成化合物Z2Y2 | |
| C. | X元素的基态原子中3个未成对电子的能量不相同 | |
| D. | X元素与Z元素可以形成离子化合物XZ3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
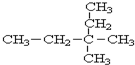 3,3-二甲基戊烷.
3,3-二甲基戊烷. .再将反应后的混合物转移到分液漏斗中,振荡、静置,然后分液.从分液漏斗放出下层液体,加入适量盐酸,再将其分成两份:向一份溶液中加入三氯化铁溶液,出现的现象是溶液呈紫色;向另一份溶液中加入浓溴水,反应的化学方程式为
.再将反应后的混合物转移到分液漏斗中,振荡、静置,然后分液.从分液漏斗放出下层液体,加入适量盐酸,再将其分成两份:向一份溶液中加入三氯化铁溶液,出现的现象是溶液呈紫色;向另一份溶液中加入浓溴水,反应的化学方程式为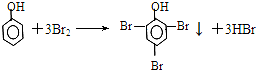 .从分液漏斗上口倒出的液体是苯.
.从分液漏斗上口倒出的液体是苯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiH4比PH3稳定 | |
| B. | 短周期元素形成离子后,最外层电子都达到8电子稳定结构 | |
| C. | Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强 | |
| D. | 某元素原子最外层只有一个电子,它跟卤素结合时所形成的化学键一定是离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使石蕊变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| B. | 使pH试纸呈深蓝色的溶液:Na+、Ba2+、HCO3-、NO3- | |
| C. | 0.1 mol•L-1AgNO3 溶液:H+、K+、SO42-、Br- | |
| D. | 0.1 mol•L-1 FeCl3溶液:H+、Na+、I-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别占4%、18%.
研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别占4%、18%.| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.050 | 0.025 | 0.025 |
| 30 | 0.050 | 0.025 | 0.025 |
| 40 | 0.036 | 0.032 | 0.010 |
| 50 | 0.036 | 0.032 | 0.010 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com