
| 化学式 | CH3COOH | HA | HNO2 | H2CO3 |
| Ka | Ka=1.8×10-5 | Ka=4.9×10-10 | Ka=4.6×10-4 | Ka1 =4.1×10-7 Ka2 =5.6×10-11 |
分析 (1)用离子方程式表示NaNO2溶液是强碱弱酸盐,水解溶液呈碱性;
(2)根据醋酸的电离平衡常数进行计算;
(3)由电离平衡常数可知,酸性H2CO3>HA>HCO3-,所以NaA溶液中通少量CO2的离子方程式为:A-+CO2+H2O=HA+HCO3-;
(4)25℃时,等物质的量浓度的HA、NaA混合溶液中,HA的Ka=4.9×10-10,所以NaA的水解Kh=$\frac{1×1{0}^{-14}}{4.9×1{0}^{-10}}$>Ka,所以水解大于电离,以水解为主溶液呈碱性,由此得出离子浓度的大小;
(5)醋酸微弱电离出氢离子与NO2-结合成HNO2,而HNO2不稳定,在稀溶液中也易分解生成NO与生成红棕的NO2,由此分析解答;
(6)NaHCO3溶液中HCO3?即水解也电离,水解程度大于电离程度,溶液显碱性,据此分析.
解答 解:(1)用离子方程式表示NaNO2溶液是强碱弱酸盐,水解溶液呈碱性,方程式为:NO2-+H2O?HNO2+OH-,故答案为:NO2-+H2O?HNO2+OH-;
(2)醋酸的电离平衡常数Ka=1.8×10-5=$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$,已知c(CH3COOH):c(CH3COO-)=5:9,则c(H+)=1.8×10-5×$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$=1×10-5mol/L,则该溶液的pH=5,故答案为:5;
(3)由电离平衡常数可知,酸性H2CO3>HA>HCO3-,所以NaA溶液中通少量CO2的离子方程式为:A-+CO2+H2O=HA+HCO3-,
故答案为:A-+CO2+H2O=HA+HCO3-;
(4)25℃时,等物质的量浓度的HA、NaA混合溶液中,HA的Ka=4.9×10-10,所以NaA的水解Kh=$\frac{1×1{0}^{-14}}{4.9×1{0}^{-10}}$>Ka,所以水解大于电离,以水解为主溶液呈碱性,所以离子浓度大小为:c(Na+)>c(A-)>c(OH-)>c(H+),故答案为:c(Na+)>c(A-)>c(OH-)>c(H+);
(5)醋酸微弱电离出氢离子与NO2-结合成HNO2,而HNO2不稳定,在稀溶液中也易分解生成NO与生成红棕的NO2,
故答案为:可行,NaNO2+CH3COOH?CH3COONa+HNO2,2HNO2=H2O+NO+NO2,HNO2不稳定会分解,使平衡不断朝生成亚硝酸的方向移动,可观察到有红棕色气体产生,故此方法可行;
(6)NaHCO3溶液中HCO3?的水解程度大于电离程度,溶液显碱性,加水稀释时溶液碱性减弱,氢离子浓度增大,故答案为:增大.
点评 本题考查了弱电解质的电离平衡、电离平衡常数的有关计算、离子浓度大小比较等知识,题目难度中等,明确弱电解质的电离平衡、盐的水解原理为解答关键,注意明确电离平衡常数的概念及计算方法,试题培养了学生的分析能力及化学计算能力.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | 由溴乙烷水解制乙醇;由丙烯和溴制1,2二溴丙烷 | |
| B. | 由苯制溴苯;由甲苯氧化制苯甲酸 | |
| C. | 由乙醇制乙烯;由乙烯与水反应制乙醇 | |
| D. | 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
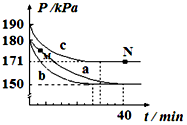 臭氧是理想的烟气脱硝试剂,原理为:2NO2(g)+O3(g)?N2O5(g)+O2(g).若在容积为10L的密闭容器中进行该反应,起始时充入0.4molNO2、0.2molO3,反应分别在a、b、c三种不同条件下进行,反应体系总压强随时间的变化如图所示.
臭氧是理想的烟气脱硝试剂,原理为:2NO2(g)+O3(g)?N2O5(g)+O2(g).若在容积为10L的密闭容器中进行该反应,起始时充入0.4molNO2、0.2molO3,反应分别在a、b、c三种不同条件下进行,反应体系总压强随时间的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有大量ClO-的溶液中:K+、OH-、I-、SO32- | |
| B. | pH值为1的溶液:Cu2+、Na+、Mg2+、NO3- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中:NH4+、Al3+、NO3-、CO32- | |
| D. | 由水电离的c(H+)=1.0×10-13 mol•L-1的溶液中:K+、NH4+、AlO2-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水盛放在棕色试剂瓶中,存放于低温避光的地方 | |
| B. | 液溴易挥发,盛放在用水液封、用橡皮胶塞密封的棕色试剂瓶中 | |
| C. | 碘易升华,盛放在棕色试剂瓶中 | |
| D. | 浓盐酸易挥发,盛装在无色密封的细口玻璃试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型化学电源,其构造如图所示:a、b两个极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型化学电源,其构造如图所示:a、b两个极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 反应类型 | 反应条件 |
| A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
| B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
| C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
| D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | l mol任何气体的体积都约是22.4L | |
| B. | l mol任何物质在标准状况下所占体积都约是22.4L | |
| C. | 不同的气体,体积相同,它们所含的分子数可能不同 | |
| D. | 在同温同压下,相同质量的氯气和氢气体积相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com