
| A. | C2H2、BeCl2 | B. | SiCl4、NH4+ | C. | H2S、P4 | D. | CH4、BF3 |
分析 A.C2H2、BeCl2为直线形分子;
B.SiCl4、NH4+均为正四面体结构,不同非金属元素间存在极性键;
C.H2S为V形分子;
D.BF3是平面三角形.
解答 解:A.C2H2、BeCl2均为直线形分子,分子中存在极性键,故A不选;
B.SiCl4、NH4+均为正四面体结构,SiCl4中存在Si-Cl极性键,NH4+中存在H-N极性键,故B选;
C.H2S为V形分子,分子中存在极性键,P4为正四面体结构,分子中没有极性键,故C不选;
D.BF3是平面三角形,CH4是正四面体,故D不选.
故选B.
点评 本题考查了共价键、分子的空间构型,题目难度不大,注意把握常见分子的空间构型.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

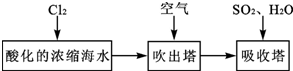
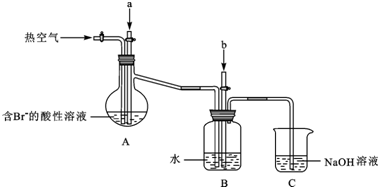
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
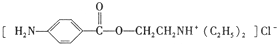 )是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
)是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下: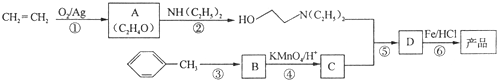
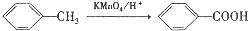
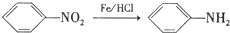
 .
.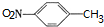 ,C中含氧官能团的名称为硝基、羧基.
,C中含氧官能团的名称为硝基、羧基.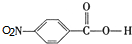 +HOCH2CH2N(C2H5)2 $\stackrel{一定条件下}{→}$
+HOCH2CH2N(C2H5)2 $\stackrel{一定条件下}{→}$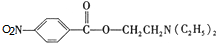 +H2O.
+H2O.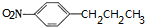 (任写一种).
(任写一种).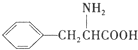 )是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式
)是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式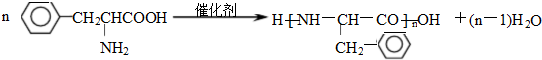 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 轮船底部焊上锌块可减级船体腐蚀,这种方法称为粞牲阳极的阴极保护法 | |
| B. | 精炼铜时,与电源负极相连的是纯铜,电极反应式为:Cu2++2e-═Cu | |
| C. | 镀层破损后,镀锌铁板比镀锡铁板更耐腐蚀 | |
| D. | 恒温下,用惰性电极电解饱和Na2CO3溶液,溶液浓度变大,有晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制Cu(OH)2悬浊液 | B. | 溴的CCl4溶液 | C. | 银氨溶液 | D. | KMnO4酸性溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要点燃后才能发生反应,所以这个反应为吸热反应 | |
| B. | 反应物所具有的总能量高于生成物所具有的总能量 | |
| C. | 断开1molH-H键和1molCl-Cl键所吸收的总能量大于形成2molH-Cl键所放出的能量 | |
| D. | 该反应中,化学能只转变为热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
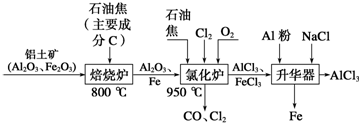
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在101kPa时,1mol H2完全燃烧生成液态水,放出285.8kJ热量,H2的燃烧热为-285.8kJ•mol-1 | |
| B. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度 | |
| C. | 在101k Pa时,1mol C与适量O2 反应生成1mol CO时,放出110.5kJ热量,则C的燃烧热为110.5kJ•mol-1 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l),△H=-57.31 kJ•mol-1.若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
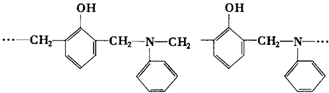
| A. | 2种,取代和加聚反应 | B. | 2种,加成和缩聚反应 | ||
| C. | 3种,取代和加聚反应 | D. | 3种,加成和缩聚反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com