
下列说法正确的是 ( )
A.淀粉和蛋白质均可作为生产葡萄糖的原料
B.实验室可用酸性高锰酸钾溶液鉴别甲苯和己烯
C.石油裂化和油脂皂化都是高分子生成小分子的过程
D.装饰材料中的甲醛和芳香烃会造成居室污染
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
CO(g)+H2O(g)  H2(g)+CO2(g) ΔH<0,在其他条件不变的情况下
H2(g)+CO2(g) ΔH<0,在其他条件不变的情况下
A.加入催化剂,加快了反应速率,反应的ΔH也随之改变
B.温度降低,正、逆反应速率都减小,反应放出的热量不变
C.恒容时充入稀有气体或充入H2,正、逆反应速率都减小
D.改变压强,反应速率发生改变,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质性质和用途的说法,正确的是( )
A.光导纤维具有很强的导电能力,所以大量用于制造通信光缆
B.明矾常用作净水剂,是因为它具有消毒杀菌的作用
C.氨常用作制冷剂,是因为其沸点极低,很容易液化
D.SiCl4在战争中常用作烟雾弹,是因为它与水反应时生成白色烟雾
查看答案和解析>>
科目:高中化学 来源: 题型:
卤素单质的性质活泼,卤素的化合物应用广泛,运用化学反应原理研究卤族元素的有关性质具有重要意义。
(1)下列关于氯水的叙述正确的是________(填写序号)。
A.氯水中存在两种电离平衡
B.向氯水中通入SO2,其漂白性增强
C.向氯水中通入氯气,c(H+)/c(ClO-)减小
D.加水稀释氯水,溶液中的所有离子浓度均减小
E.加水稀释氯水,水的电离平衡向正反应方向移动
F.向氯水中加少量固体NaOH,可能有c(Na+)=c(Cl-)+c(ClO-)
(2)工业上通过氯碱工业生产氯气,其反应的离子方程式为____。
(3)常温下,已知25 ℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HClO | H2CO3 |
| 电离平衡常数 | K=3.0×10-8 | K1=4.4×10-7,K2=4.7×10-11 |
写出84消毒液(主要成分为NaClO)露置在空气中发生反应的有关化学方程式________________________。若将84消毒液与洁厕剂(含有浓盐酸)混合使用可能会导致中毒,请用离子方程式解释有关原因__________________。
(4)碘钨灯具有比白炽灯寿命长且环保节能的特点。一定温度下,灯内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:W(s)+I2(g)WI2(g)。为模拟上述反应,准确称取0.508 g碘、0.736 g金属钨置于50.0 mL的密闭容器中,加热使其反应。
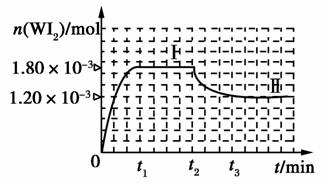
如图是WI2(g)的物质的量随时间变化的关系图像,其中曲线I(0~t2时间段)的反应温度为T1,曲线Ⅱ(从t2开始)的反应温度为T2,且T2>T1。则:
①该反应的ΔH________0(填“>”、“=”或“<”)。
②从反应开始到t1时间内的平均反应速率v(I2)=________。
③下列说法中不正确的是________(填序号)。
A.利用该反应原理可以提纯钨
B.该反应的平衡常数表达式是K=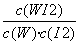
C.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
(5)25 ℃时,向5 mL含有KCl和KI浓度均为0.1 mol·L-1的混合液中,滴加6 mL 0.1 mol·L-1的AgNO3溶液,先生成的沉淀是________,溶液中离子浓度由大到小的顺序是________[不考虑H+和OH-。25 ℃时Ksp(AgCl)=1.8×10-10、Ksp(AgI)=8.3×10-17]。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验现象中,由于发生取代反应而引起的是( )
A.乙烯通入溴的四氯化碳溶液中,溶液褪色
B.甲烷和氯气的混合气体在光照后,瓶壁上有油状液滴附着
C.苯滴加到溴水中,振荡后水层接近无色
D.将灼热的铜丝迅速插入乙醇中,反复多次,有刺激性气味产生
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制取的乙烯常含有少量二氧化硫,现设计如下实验,确认混合气体中有乙烯和二氧化硫。

(1)a、b、c、d装置可盛放的试剂是:a________,b______,c_____,d______。
A.品红溶液 B.NaOH溶液C.浓硫酸 D.酸性高锰酸钾溶液
(2)确定含有乙烯的现象是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | N | S | N | Cl- |
| 浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断PM2.5的酸碱性为 ,试样的pH= 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+ O2(g)
O2(g) H2O(g) ΔH=-241.8 kJ·mol-1
H2O(g) ΔH=-241.8 kJ·mol-1
C(s)+ O2(g)
O2(g) CO(g) ΔH=-110.5 kJ·mol-1
CO(g) ΔH=-110.5 kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式: 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:
N2(g)+O2(g) 2NO(g) ΔH>0
2NO(g) ΔH>0
若1 mol空气含0.8 mol N2和0.2 mol O2,1 300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g) 2C(s)+O2(g)
2C(s)+O2(g)
已知该反应的ΔH>0,简述该设想能否实现的依据:
。
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
四种短周期主族元素A、B、C、D的原子序数依次增大,它们的原子序数之和为36,最外层电子数之和为14;A、C原子的最外层电子数之和等于B原子的次外层电子数,B、D同主族。下列叙述不正确的是
A.A、B、D三种元素形成的化合物一定是强酸
B.B元素在地壳中的含量一定最高
C.C元素在元素周期表中一定位于第三周期第ⅠA族
D.D元素与氢元素形成化合物的化合物常温下一定为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能说明X元素比Y元素的非金属性强的是
A.与H2化合时X单质比Y单质容易
B.X的最高价氧化物对应水化物的酸性比Y的最高价氧化物对应水化物的酸性强
C.X原子的最外层电子数比Y原子的最外层电子数多
D.X单质可以把Y从其氢化物中置换出来
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com