
【题目】已知如表25℃时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH,HClO两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )
CH3COOH | HClO | H2CO3 |
Ka=1.8×10﹣5 | Ka=3.0×10﹣8 | Ka1=4.4×10﹣7 Ka2=4.7×10﹣11 |
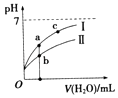
A.如图中的两种酸分别和等浓度的NaOH溶液刚好完全反应,消耗碱的体积相等
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO﹣+CO2+H2O═2HClO+CO32﹣
C.a、b、c三点所示溶液中水的电离程度c>a>b
D.图象中,Ⅰ表示CH3COOH,Ⅱ表示HClO,且溶液导电性:c>b>a
【答案】C
【解析】解:A.PH值相同,电离平衡常数越小,酸的浓度越大,所以次氯酸消耗碱的体积大于醋酸,故A错误;
B.酸性强弱H2CO3>HClO>HCO3﹣ , 根据强酸制取弱酸知,二者反应生成碳酸氢钠和次氯酸,离子方程式为ClO﹣+CO2+H2O═HClO+HCO3﹣ , 故B错误;
C.酸溶液中氢离子浓度越小,酸抑制水电离程度越小,a、b、c三点溶液中C(H+)大小顺序是b>a>c,所以水电离程度c>a>b,故C正确;
D.pH相等的CH3COOH、HClO,稀释相同的倍数时,较强酸中氢离子浓度小于较弱酸,则较弱酸的pH小于较强酸,酸性CH3COOH>HClO,所以I表示CH3COOH,Ⅱ表示HClO,酸中离子浓度越大则酸溶液的导电性越强,所以溶液导电性:b>a>c,故D错误;
故选C.
A.PH值相同,电离平衡常数越小,酸的浓度越大;
B.酸性强弱H2CO3>HClO>HCO3﹣ , 根据强酸制取弱酸知,二者反应生成碳酸氢钠和次氯酸;
C.酸溶液中氢离子浓度越小,酸抑制水电离程度越小;
D.pH相等的CH3COOH、HClO,稀释相同的倍数时,较强酸中氢离子浓度小于较弱酸,则较弱酸的pH小于较强酸,酸中离子浓度越大则酸溶液的导电性越强.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
【题目】温度为T时,在4.0L恒容密闭容器中充入2.0mol PCl5 , 发生反应:PCl5(g)PCl3(g)+Cl2(g),反应时间(t)与容器内气体总压强(p)的数据见表:
t/s | 0 | 50 | 150 | 250 | 350 |
总压强p/100kPa | 100 | 116 | 119 | 120 | 120 |
(1)由总压强p和起始压强p0计算反应物PCl5的转化率α(PCl5)的表达式为?平衡时PCl5的转化率为多少?
(2)反应在前50s的平均速率v(PCl3)为多少?
(3)该温度下的平衡常数为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).
(1)制备氯气选用的药品为二氧化锰和浓盐酸,则相关的化学反应方程式为: .
(2)装置B中饱和食盐水的作用是 .
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入 .
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 无水CaCl2 | 浓硫酸 | 无水CaCl2 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D,E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为色,打开D装置中活塞,将D中少量溶液加入装置E中,振荡.观察到的现象是 . 经认真考虑,有同学提出该实验方案仍有不足,请说明其中不足的原因是 .
(5)装置F中用足量NaOH溶液吸收剩余的氯气,试写出相应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第n电子层当它作为最外电子层时,最多容纳的电子数与n-1层相同,当它作为原子的次外层时,其电子数比n+1层最多容纳的电子数多10个,则此电子层是( )
A.KB.LC.MD.N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种物质有如图所示相互转化关系.
(1)若Z、W是两种酸,X黄绿色气体,则:X、Y反应的化学方程式是;Z、W的混合溶液久置后的成分是(填化学式).
(2)若X、W是两种金属,W的合金用于制造人造骨骼,与人体有很好的融合性,该反应常用于冶炼贵重金属.则:X在空气中变暗的化学方程式为 .
(3)若X、Y是单质,Z、W均为化合物,W的摩尔质量比Z高71,则:Z的化学式为 . 有白烟生成的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数数值,下列叙述中正确的是( )
A.标准状况下,11.2 L氦气所含的原子数为NA
B.标准状况下,11.2g氢气所含的原子数约为5.6 NA
C.常温常压下,48 g O3含有的氧原子数约为3NA
D.36.5g HCl中含有的氯原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol氯化氢中含个氢原子,4.4g二氧化碳与g硫酸所含的分子数相等,它们所含氧原子数之比是 .
根据下列物质回答问题:①液态氯化氢 ②二氧化碳③氯化铁溶液 ④稀硫酸 ⑤金刚石,属于电解质的是:(填编号,下同),属于非电解质的是_.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com