
【题目】氯碱工业是以电解饱和食盐水为原理的重要化工生产业.
(1)电解饱和食盐水的化学方程式是
(2)电解时阳极区溶液的pH用盐酸控制在2~3,用化学平衡移动原理解释盐酸的作用;
(3)用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42﹣等杂质.某次除杂操作时,往粗盐水中先加入过量的(填化学式),至沉淀不再产生后,再加入过量的(填化学式)和NaOH,充分反应后将沉淀一并滤去.经检测发现滤液中仍含有一定量的SO42﹣ , 解释其原因[已知:Ksp(BaSO4)=1.1×10﹣10、Ksp(BaCO3)=5.1×10﹣9].
(4)食盐水中若含有NH4+ , 会在阳极产生难溶于水的NCl3 , 写出该电极反应式 .
【答案】
(1)2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(2)使氯气与水的反应(Cl2+H2O?HCl+HClO)平衡向右移动,减少氯气溶解
(3)BaCl2;Na2CO3;由于BaSO4和BaCO3的Ksp相差不大,当溶液中的CO32﹣较大时,BaSO4会部分转化为BaCO3
(4)NH ![]() ﹣6e﹣+3Cl﹣=NCl3+4H+
﹣6e﹣+3Cl﹣=NCl3+4H+
【解析】解:(1)电解饱和食盐水生成氯气、氢气和氢氧化钠,方程式为2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑,所以答案是:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,所以答案是:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑;(2)电解时用盐酸控制阳极区溶液的pH在2~3的作用是促使化学平衡Cl2+H2OHCl+HClO向左移动,减少Cl2在水中的溶解,有利于Cl2的逸出,所以答案是:使氯气与水的反应(Cl2+H2OHCl+HClO)平衡向右移动,减少氯气溶解;(3)加入过量的Na2CO3和NaOH,可分别除去Ca2+、Mg2+ , 在除杂的过程中每步加入的试剂必须是过量的,使离子除尽;过量的离子在下一步中必须出去,故先加入BaCl2 , 除去硫酸根,过量的钡离子,加入Na2CO3除去.BaSO4和BaCO3的Ksp相差不大,当溶液中存在大量CO
2NaOH+H2↑+Cl2↑;(2)电解时用盐酸控制阳极区溶液的pH在2~3的作用是促使化学平衡Cl2+H2OHCl+HClO向左移动,减少Cl2在水中的溶解,有利于Cl2的逸出,所以答案是:使氯气与水的反应(Cl2+H2OHCl+HClO)平衡向右移动,减少氯气溶解;(3)加入过量的Na2CO3和NaOH,可分别除去Ca2+、Mg2+ , 在除杂的过程中每步加入的试剂必须是过量的,使离子除尽;过量的离子在下一步中必须出去,故先加入BaCl2 , 除去硫酸根,过量的钡离子,加入Na2CO3除去.BaSO4和BaCO3的Ksp相差不大,当溶液中存在大量CO ![]() 时,发生BaSO4(s)+CO
时,发生BaSO4(s)+CO ![]() (aq)=BaCO3(s)+SO
(aq)=BaCO3(s)+SO ![]() (aq),BaSO4(s)会部分转化为BaCO3(s),所以答案是:BaCl2; Na2CO3;由于BaSO4和BaCO3的Ksp相差不大,当溶液中的CO
(aq),BaSO4(s)会部分转化为BaCO3(s),所以答案是:BaCl2; Na2CO3;由于BaSO4和BaCO3的Ksp相差不大,当溶液中的CO ![]() 较大时,BaSO4会部分转化为BaCO3;(4)NH4+被氧化生成NCl3 , 电极方程式为NH4+﹣6e﹣+3Cl﹣=NCl3+4H+ , 所以答案是:NH
较大时,BaSO4会部分转化为BaCO3;(4)NH4+被氧化生成NCl3 , 电极方程式为NH4+﹣6e﹣+3Cl﹣=NCl3+4H+ , 所以答案是:NH ![]() ﹣6e﹣+3Cl﹣=NCl3+4H+ .
﹣6e﹣+3Cl﹣=NCl3+4H+ .


科目:高中化学 来源: 题型:
【题目】某温度下,硫酸钡与水组成的混合物中,存在下列过程:BaSO4(s)Ba2++SO ![]() ,向其中加入少量硫酸钠固体,下列说法错误的是( )
,向其中加入少量硫酸钠固体,下列说法错误的是( )
A.BaSO4的电离程度减小
B.BaSO4溶解的量减小
C.c(Ba2+)与c(SO42﹣)的乘积增大
D.溶液的导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是 ( )
A. 氢氧化钠溶液与稀醋酸反应:OH-+H+=H2O
B. 碳酸钙与足量稀硝酸反应:CaCO3+2H+=Ca2++H2O+CO2↑
C. 氯化铝溶液与过量氨水反应:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
D. 钠与水反应:Na+2H2O=Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。利用如图装置可验证同主族元素非金属性的变化规律
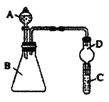
(1)仪器A的名称为_____,干燥管D的作用为__________。
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液____(填现象),即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用____溶液吸收尾气。
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液_______(填现象),即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰试验,应在两装置间添加装有______溶液的洗气瓶除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用哪组试剂可鉴别在不同试剂瓶内的1—己烯、甲苯和丙醛( )
A.KMnO4酸性溶液和溴的CCl4溶液。
B.银氨溶液和溴的CCl4溶液。
C.FeCl3溶液和银氨溶液。
D.银氨溶液和KMnO4酸性溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 0.1 mol 的![]() 中,含有0.6NA个中子
中,含有0.6NA个中子
B. 7.1g Cl2通入足量的NaOH溶液中,反应转移电子的数目为0.2NA
C. 标准状况下,1.12L 的SO3所含的原子数目为0.2NA
D. 将足量的MnO2与含HCl 4 mol的浓盐酸混合后充分加热,生成的气体分子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟电化学反应装置图.下列说法正确的是( ) 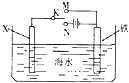
A.若X为碳棒,开关K置于N处,可以加快铁的腐蚀
B.若X为碳棒,开关K置于N处,则X极附近溶液变黄色
C.若X为锌,开关K置于M处,保护铁电极则为牺牲阳极的阴极保护法
D.若X为锌,开关K置于M处,则X电极的反应式为:O2+4e+2H2O→4OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于S、SO2、H2SO4的叙述中,正确的是
A.硫是一种易溶于水的黄色晶体 B.SO2溶于水生成H2SO4
C.用氢氧化钠溶液处理含有SO2的尾气 D.浓H2SO4不稳定,光照易分解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com