
【题目】根据所学知识,完成下面题目:
(1)亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过反应获得:NO(g)+Cl2(g)═2ClNO(g).①氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g)△H1 K1
4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)△H2 K2
2NO(g)+Cl2(g)2ClNO(g)△H3 K3
则△H3=(用△H1和△H2表示),K3=(用K1和K2表示).
②NaOH溶液可以吸收氮的氧化物:NO2+NO+2NaOH=2NaNO2+H2O.室温下,用一定量的NaOH
溶液吸收NO、NO2混合气体,得到0.1mol/L的NaNO2溶液.已知HNO2的电离常数Ka=7.1×10﹣4 ,
那么室温下NO2﹣的水解常数Kh= , 0.1mol/L NaNO2溶液中从c(Na+ )、c(OH﹣ )、c(NO2﹣ )、c(HNO2)的大小顺序为 .
(2)在3.0L密闭容器中,通入0.10mol CH4和0.20molNO2 , 在一定温度下进行反应,CH4(g)+2NO2(g)CO2(g)+N2(g)+2H2O(g)△H<0,反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
总压强p/100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
①由表中数据计算0~4min内v(NO2)= , 该温度下的平衡常数K=(不必带单位).
②在一恒容装置中,通入一定量CH4和NO2 , 测得在相同时间内,在不同温度下,NO2的转化率如图(横坐标为反应温度,纵坐标为NO2转化率/%):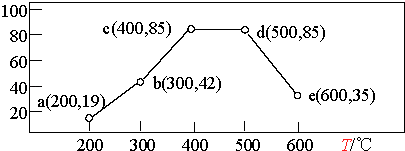
则下列叙述正确的是 .
A.若温度维持在200℃更长时间,NO2的转化率将大于19%
B.反应速率:b点的v (逆)>e点的 v (逆)
C.平衡常数:c点=d点
D.提高b点时NO2的转化率和反应速率,可适当升温或增大c(CH4)
【答案】
(1)2△H1﹣△H2;![]() ;1.4×10﹣11;c(Na+ )>c(NO2﹣)>c(OH﹣)>c(HNO2)
;1.4×10﹣11;c(Na+ )>c(NO2﹣)>c(OH﹣)>c(HNO2)
(2)0.01mol/(L?min);0.675;AD
【解析】解:(1)①已知:I.2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g)Ⅱ.4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)根据盖斯定律,Ⅰ×2﹣Ⅱ可得:2NO(g)+Cl2(g)2ClNO(g),该反应△=2△H1﹣△H2 , 平衡常数K3= ![]() ,所以答案是:2△H1﹣△H2;
,所以答案是:2△H1﹣△H2; ![]() ;②NO2﹣的水解常数Kh=
;②NO2﹣的水解常数Kh= ![]() =
= ![]() =
= ![]() =
= ![]() =1.4×10﹣11 , 溶液中NO2﹣离子水解,溶液呈碱性,水也电离生成氢氧根离子,浓度顺序为:c(Na+ )>c(NO2﹣)>c(OH﹣)>c(HNO2),所以答案是:1.4×10﹣11;c(Na+ )>c(NO2﹣)>c(OH﹣)>c(HNO2);(2)①压强之比等于物质的量之比,则4min时混合气体总物质的量为(0.1+0.2)mol×
=1.4×10﹣11 , 溶液中NO2﹣离子水解,溶液呈碱性,水也电离生成氢氧根离子,浓度顺序为:c(Na+ )>c(NO2﹣)>c(OH﹣)>c(HNO2),所以答案是:1.4×10﹣11;c(Na+ )>c(NO2﹣)>c(OH﹣)>c(HNO2);(2)①压强之比等于物质的量之比,则4min时混合气体总物质的量为(0.1+0.2)mol× ![]() =0.36mol,由方程式可知1molNO2反应时混合气体物质的量增大1mol,则反应的NO2为2×(0.36﹣0.3)mol=0.12mol,0~4min内v(NO2)=
=0.36mol,由方程式可知1molNO2反应时混合气体物质的量增大1mol,则反应的NO2为2×(0.36﹣0.3)mol=0.12mol,0~4min内v(NO2)= ![]() =0.01mol/(Lmin);
=0.01mol/(Lmin);
8min时处于平衡状态,压强之比等于物质的量之比,则平衡时混合气体总物质的量为(0.1+0.2)mol× ![]() =0.375mol,设参加反应的均为为xmol,则:
=0.375mol,设参加反应的均为为xmol,则:
CH4(g)+2NO2(g)CO2(g)+N2(g)+2H2O(g)
起始量(mol):0.1 0.2 0 0 0
变化量(mol):x 2x x x 2x
平衡量(mol):0.1﹣x 0.2﹣2x x x 2x
所以0.1﹣x+0.2﹣2x+x+x+2x=0.375,解得x=0.075,
则平衡常数K= ![]() =
=  =0.675,所以答案是:0.01mol/(Lmin);0.675;②图为测得在相同时间内,在不同温度下NO2的转化率,温度400℃、500℃转化率最大,处于平衡状态,之前没有到达平衡,之后升高温度,转化率降低,平衡逆向移动.A.图中200℃时,反应没有到达平衡,向正反应进行,温度维持在200℃更长时间,NO2的转化率将大于19%,故A正确;B.b点反应向正反应进行,e处于平衡状态,且E温度高,故b点的v (逆)<e点的 v (逆),故B错误;C.c、d温度不同,平衡常数不同,故C错误;D.增大反应物浓度可以加快反应速率,提高其他物质的转化率,b向正反应进行,当升温可以加快速率,反应继续向正反应进行并到达平衡,故D正确,故选:AD.
=0.675,所以答案是:0.01mol/(Lmin);0.675;②图为测得在相同时间内,在不同温度下NO2的转化率,温度400℃、500℃转化率最大,处于平衡状态,之前没有到达平衡,之后升高温度,转化率降低,平衡逆向移动.A.图中200℃时,反应没有到达平衡,向正反应进行,温度维持在200℃更长时间,NO2的转化率将大于19%,故A正确;B.b点反应向正反应进行,e处于平衡状态,且E温度高,故b点的v (逆)<e点的 v (逆),故B错误;C.c、d温度不同,平衡常数不同,故C错误;D.增大反应物浓度可以加快反应速率,提高其他物质的转化率,b向正反应进行,当升温可以加快速率,反应继续向正反应进行并到达平衡,故D正确,故选:AD.
解:(1)①已知:I.2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g)
Ⅱ.4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)
根据盖斯定律,Ⅰ×2﹣Ⅱ可得:2NO(g)+Cl2(g)2ClNO(g),该反应△=2△H1﹣△H2 , 平衡常数K3= ![]() ,
,
所以答案是:2△H1﹣△H2; ![]() ;
;
②NO2﹣的水解常数Kh= ![]() =
= ![]() =
= ![]() =
= ![]() =
= ![]() =1.4×10﹣11 , 溶液中NO2﹣离子水解,溶液呈碱性,水也电离生成氢氧根离子,浓度顺序为:c(Na+ )>c(NO2﹣)>c(OH﹣)>c(HNO2),
=1.4×10﹣11 , 溶液中NO2﹣离子水解,溶液呈碱性,水也电离生成氢氧根离子,浓度顺序为:c(Na+ )>c(NO2﹣)>c(OH﹣)>c(HNO2),
所以答案是:1.4×10﹣11;c(Na+ )>c(NO2﹣)>c(OH﹣)>c(HNO2);(2)①压强之比等于物质的量之比,则4min时混合气体总物质的量为(0.1+0.2)mol× ![]() =0.36mol,由方程式可知1molNO2反应时混合气体物质的量增大1mol,则反应的NO2为2×(0.36﹣0.3)mol=0.12mol,0~4min内v(NO2)=
=0.36mol,由方程式可知1molNO2反应时混合气体物质的量增大1mol,则反应的NO2为2×(0.36﹣0.3)mol=0.12mol,0~4min内v(NO2)= ![]() =0.01mol/(Lmin);
=0.01mol/(Lmin);
8min时处于平衡状态,压强之比等于物质的量之比,则平衡时混合气体总物质的量为(0.1+0.2)mol× ![]() =0.375mol,设参加反应的均为为xmol,则:
=0.375mol,设参加反应的均为为xmol,则:
CH4(g)+2NO2(g)CO2(g)+N2(g)+2H2O(g)
起始量(mol):0.1 0.2 0 0 0
变化量(mol):x 2x x x 2x
平衡量(mol):0.1﹣x 0.2﹣2x x x 2x
所以0.1﹣x+0.2﹣2x+x+x+2x=0.375,解得x=0.075,
则平衡常数K= ![]() =
=  =0.675,
=0.675,
所以答案是:0.01mol/(Lmin);0.675;
②图为测得在相同时间内,在不同温度下NO2的转化率,温度400℃、500℃转化率最大,处于平衡状态,之前没有到达平衡,之后升高温度,转化率降低,平衡逆向移动.
A.图中200℃时,反应没有到达平衡,向正反应进行,温度维持在200℃更长时间,NO2的转化率将大于19%,故A正确;
B.b点反应向正反应进行,e处于平衡状态,且E温度高,故b点的v (逆)<e点的 v (逆),故B错误;
C.c、d温度不同,平衡常数不同,故C错误;
D.增大反应物浓度可以加快反应速率,提高其他物质的转化率,b向正反应进行,当升温可以加快速率,反应继续向正反应进行并到达平衡,故D正确,
故选:AD.
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效),以及对化学平衡的计算的理解,了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】下列离子的检验能达到预期目的是( )
A. 检验![]() :先滴加氯水,再滴加KSCN溶液,若变红,则有Fe2+
:先滴加氯水,再滴加KSCN溶液,若变红,则有Fe2+
B. 检验NH4+:先滴加NaOH溶液,加热,用湿润蓝色石蕊试纸检验,若变红,则有NH4+
C. 检验Cl—:先滴加AgNO3溶液,再滴加硝酸,若有白色沉淀,则有Cl—
D. 检验![]() :滴加硝酸,将生成的气体通入品红溶液,若品红溶液褪色,则有
:滴加硝酸,将生成的气体通入品红溶液,若品红溶液褪色,则有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组学生用图中所示装置(部分夹持装置略)探究NO与Na2O2反应的情况,提出假设并进行相关实验。

该研究性学习小组同学认为NO 易与O2发生反应,应该更易被Na2O2氧化。查阅资料:2NO+Na2O2=2NaNO2;2NaNO2+2HCl=2NaCl+NO2↑+NO↑+H2O; 酸性条件下,NO 能与MnO4-反应生成NO3-和Mn2+。
(1)在反应前,打开弹簧夹,通入一段时间N2,目的是__________________________。
(2)A 中反应的氧化剂与还原剂的物质的量之比为______________。
(3)B 中观察到的主要现象是____________(填字母编号)。
a.铜片逐渐溶解,溶液变为蓝色 b.有红棕色气泡产生 C.有无色气泡产生
(4)C、E 中所盛装的试剂不能是________(填字母编号)。
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
(5)F 中反应的离子方程式是_________________________________________。
(6)充分反应后,检验D装置中产物的方法是: _____________________________ ,则产物是NaNO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列两组热化学方程式中,有关△H的比较正确的是( ) ①CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H2
②NaOH(aq)+ ![]() H2SO4(浓)═
H2SO4(浓)═ ![]() Na2SO4(aq)+H2O(l)△H3
Na2SO4(aq)+H2O(l)△H3
NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H4 .
A.△H1>△H2;△H3>△H4
B.△H1>△H2;△H3<△H4
C.△H1=△H2;△H3<△H4
D.△H1<△H2;△H3<△H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. 某课外活动小组为了检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉。

请回答下列问题:
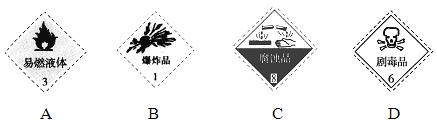
(1)对于易燃、易爆、有毒的化学物质,往往会在其包装上面贴上危险警告标签。浓硫酸的危险警告标签是_______。
(2)装置A中发生反应的化学方程式为____________________________。
(3)此实验成败的关键在于控制反应产生气体的速率不能过快,因此设计了虚框部分的装置,则正确的操作顺序是_________________(用操作编号填写)
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(4)实验时,装置C中的现象为_______________________________________;
(5)当D中产生_______________________________________现象时,可以说明使E中澄清石灰水变浑浊的是CO2,而不是SO2;
(6)Ⅰ若为检验浓硫酸与木炭在加热条件下生成的水蒸汽,可在装置__________之间加上一个盛有无水CuSO4的硬质玻璃管。
Ⅱ. Cu与浓硫酸反应可得硫酸铜溶液。某学习小组将铜屑放入一定浓度的硫酸中,加热并不断鼓入空气也可得硫酸铜溶液,其反应原理为2Cu+O2+2H2SO4![]() 2CuSO4+2H2O。现欲将12.8g铜完全溶解,加蒸馏水后得200 mL溶液。计算:
2CuSO4+2H2O。现欲将12.8g铜完全溶解,加蒸馏水后得200 mL溶液。计算:
(7)参加反应的氧气在标准状况下的体积是___________________ L。
(8)所得硫酸铜溶液的物质的量浓度是__________________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)C8H8(g)+H2(g)△H>0 Ⅰ.某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2[来源:] | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)当反应进行到20min时,该段时间内H2的平均反应速率是 .
(2)该温度下,该反应的化学平衡常数是 .
化学键 | C﹣H | C﹣C | C=C | H﹣H |
键能/kJmol1 | 412.5 | 348 | 612 | 436 |
(3)已知: 计算上述反应的△H=kJmol﹣1 . 若保持其他条件不变,用0.40mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是 . 此时,该反应是否达到了平衡状态?(填“是”或“否”).
Ⅱ.工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示.
(4)由图Ⅰ可知,T1T2(填“大于”、“小于”或“等于”).
(5)由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将(填“越大”、“越小”或“不变”),原因是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com