
A.由于NaCl 晶体和CsCl晶体中正负离子半径比(
| ||
| B.CaF2晶体中,Ca2+配位数为8,F-配位数为4不相等,主要是由于F-、Ca2+电荷(绝对值)不相同 | ||
| C.MgO的熔点比MgCl2高主要是因为MgO的晶体能比MgCl2大 | ||
| D.MCO3中M2+半径越大,MCO3热分解温度越低 |
 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源:2013届四川省巴中市四县中高二上期期末联考化学试卷 题型:选择题
关于下列几种离子晶体,说法不正确的是( )
A.由于NaCl
晶体和CsCl晶体中正负离子半径比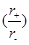 不相等,所以两晶体中离子的配位数不相等
不相等,所以两晶体中离子的配位数不相等
B.CaF2晶体中,Ca2+配位数为8,F-配位数为4不相等,主要是由于F-、Ca2+电荷(绝对值)不相同
C.MgO的熔点比MgCl2高主要是因为MgO的晶体能比MgCl2大
D.MCO3中M2+半径越大,MCO3热分解温度越低
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省成都十八中高二(上)期中化学试卷(解析版) 题型:选择题
 )不相等,所以两晶体中离子的配位数不相等
)不相等,所以两晶体中离子的配位数不相等查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川省巴中市四县中高二上期期末联考化学试卷 题型:单选题
关于下列几种离子晶体,说法不正确的是( )
A.由于NaCl 晶体和CsCl晶体中正负离子半径比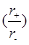 不相等,所以两晶体中离子的配位数不相等 不相等,所以两晶体中离子的配位数不相等 |
| B.CaF2晶体中,Ca2+配位数为8,F-配位数为4不相等,主要是由于F-、Ca2+电荷(绝对值)不相同 |
| C.MgO的熔点比MgCl2高主要是因为MgO的晶体能比MgCl2大 |
| D.MCO3中M2+半径越大,MCO3热分解温度越低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com