
用11.5g金属钠放入水中,要使100个水分子溶有1个钠离子,则需加水 g。
909g
解析利用n=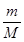 计算Na的物质的量,由Na原子守恒可知,n(Na)=n(Na+),再利用100个水分子中溶有1个钠离子来列式计算出水的物质的量及其质量即可。
计算Na的物质的量,由Na原子守恒可知,n(Na)=n(Na+),再利用100个水分子中溶有1个钠离子来列式计算出水的物质的量及其质量即可。
n(Na)=n(Na+)=11.5g÷23g/mol=0.5mol
根据方程式2Na+2H2O=2NaOH+H2↑可知参加反应的水的物质的量是0.5mol
由100个水分子中溶有1个钠离子可知,反应后水的物质的量是0.5mol×100=50mol,所以共计需要水的物质的量是50mol+0.5mol=50.5mol,质量是50.5mol×18g/mol=909g。
考点:考查钠与水反应的有关计算
点评:该题是中等难度的试题,主要是考查学生对钠与水原理以及物质的量计算的了解掌握情况,有利于培养学生的逻辑推理能力和规范答题能力。明确质量、物质的量的关系及信息中水分子与钠离子的关系即可解答。


科目:高中化学 来源: 题型:填空题
有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)氧化成硫酸盐。运用该原理生产铜和绿矾(FeSO4·7H2O)的流程如下: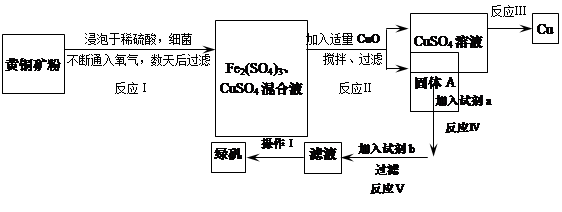
回答下列问题:
(1)已知:
| | Fe2+ | Cu2+ | Fe3+ |
| 开始转化成氢氧化物沉淀时的pH | 7.6 | 4.7 | 2.7 |
| 完全转化成氢氧化物沉淀时的pH | 9.6 | 6.7 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应: 2NaAl(OH)4+CO2→2Al(OH)3↓ +Na2CO3+H2O
(1)上述五中物质中沸点最低物质的结构式为______________,由上述物质中的两种元素按原子个数比1:1形成的离子化合物的电子式为__________________(写一例)
(2)Al元素的单质有许多不同于其他金属的特性,请列举2例(也可以用化学方程式表示)
______________________、__________________________________.
(3)氢有3种稳定同位素,H氕、 D氘、 T氚,分别为丰度a、b、c,则计算氢元素的近似相对原子质量的表达式为______________________________________________.
甲认为H可以排在周期表ⅠA族,也可以排在ⅦA族;而乙同学认为H也可以与碳一样,排在ⅣA族,乙同学的理由是__________________________________________________。
(4)己知通入二氧化碳336 L(标准状况下),理论上生成Al(OH)3 ________________mol,
实际上生成24 mol Al(OH)3和15 mol Na2CO3,Al(OH)3比理论上要少的原因是:________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
联碱法(候氏制碱法)和氨碱法的生产流程简要表示如下图: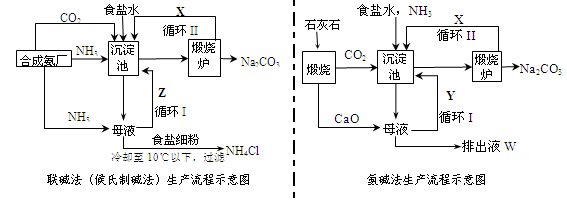
(1)两种方法的沉淀池中均发生的反应化学方程式为_____________________________。
(2)若沉淀池含800.00 mol NH3的水溶液质量为54.00 kg,向该溶液通入二氧化碳至反应完全,过滤,得到滤液31.20kg,则NH4HCO3的产率为______________%。
(3)在氨碱法生产过程中氨要循环使用,但不需要补充,在母液中加生石灰前先要加热的原因是 ___ 。
(4)根据联碱法中从滤液中提取氯化铵晶体的过程推测,所得结论正确是_______(选填编号)。
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气能增大NH4+的浓度,使氯化铵更多析出
c.加入食盐细粉能提高Na+的浓度, 使NaHCO3结晶析出
d.通入氨气能使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(5)联碱法相比于氨碱法,氯化钠利用率从70%提高到90%以上,主要是设计了循环Ⅰ,联碱法的另一项优点是__________________________________________________。
(6)从沉淀池析出的晶体含有NaCl杂质,某同学在测定其NaHCO3的含量时,称取5.000g试样,配制成100mL溶液,用标准盐酸溶液滴定(用甲基橙做指示剂),测定数据记录如下:
| 滴定次数 | 待测液(mL) | 0.6000mol/L盐酸溶液的体积(mL) | |
| 初读数 | 终读数 | ||
| 第一次 | 20.00 | 1.00 | 21.00 |
| 第二次 | 20.00 | 如右图Ⅰ | 如右图Ⅱ |
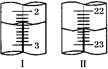 显示消耗的盐酸溶液体积为 。
显示消耗的盐酸溶液体积为 。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某氧化铁样品中含有少量的FeSO4杂质。某同学要测定其中铁元素的质量分数,他设计了如下方案进行测定,操作流程为: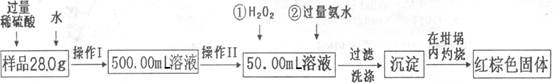
请根据流程回答:
(1)操作I中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有 (填仪器名称)。
(2)操作II中必须用到的仪器是 。
| A.50mL量筒 | B.100mL量筒 |
| C.50mL酸式滴定管 | D.50mL碱式滴定管 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40mol.L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL。计算该样品中氯的物质的量,并求出FeClx中x值:
(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为 。在实验室中,FeCl2可用铁粉和 盐酸反应制备,FeCl3可用铁粉和 反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为
与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为 ,该电池总反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)铁、铝、铜、硅及其合金材料在生产生活中有着广泛的应用。请回答下列有关问题。
(1)目前已冶炼出纯度达99.9999%的铁。下列关于纯铁的叙述错误的是
(填字母)。
| A.硬度比钢小,熔点比钢高 | B.不能与盐酸反应 |
| C.与不锈钢成分相同 | D.在冷的浓硫酸中钝化 |
 6Cu+SO2↑,该反应的氧化剂是
6Cu+SO2↑,该反应的氧化剂是 
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组在网上收集到信息:钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后得到的白色产物进行了如下探究:
【实验操作】将燃烧的钠迅速伸入装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底有黑色颗粒,瓶壁上附着白色物质。
【提出假设】
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
【设计方案】该小组对燃烧后生成的白色物质进行如下探究:
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液。②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | ①出现白色沉淀 ②无明显现象 | 白色物质为Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com