
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4 + 5H2C2O4 + 3H2SO4 = K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
(实验内容及记录)
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 室温下溶液颜色褪至无色所需时间 / min | |||
0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05mol/L KMnO4溶液 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是___________________________________。
(2)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)= ________。
(3)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
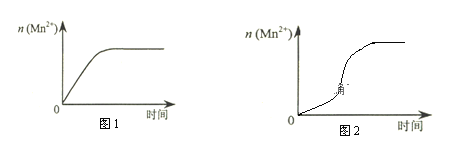
①该小组同学提出的假设是___________________________________________________。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间 / min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L稀硫酸 | 0.05mol/L KMnO4溶液 | |||
4 | 3.0 | 2.0 | 2.0 | 3.0 | _______ | t |
③若该小组同学提出的假设成立,应观察到的现象是_____________________________________。
【答案】其他条件相同时,增大H2C2O4浓度(或反应物浓度),反应速率增大 1.0×10-2 mol / (L·min) 生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用) MnSO4 与实验1比较,溶液褪色所需时间短或所用时间(t)小于1.5min(或其他合理答案)
【解析】
(1)从表中数据可知改变的条件是H2C2O4浓度,根据H2C2O4溶液浓度不同对反应速率的影响进行解答;
(2)根据![]() 进行计算
进行计算
(3)①由图乙可知反应开始后锰离子浓度增大,反应速率增加的比较快,所以探究的是硫酸镁在反应中的作用;
②作对比实验时,除了加入MnSO4不同外,其它量完全相同,据此进行解答;
③若反应加快,说明Mn2+是催化剂,反应过程中溶液褪色时间减少。
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大H2C2O4浓度(或反应物浓度),反应速率增大,
故答案为:其他条件相同时,增大H2C2O4浓度(或反应物浓度),反应速率增大;
(2)由实验1中数据可知,用KMnO4的浓度变化表示的反应速率为υ(KMnO4)=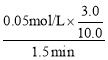 =1.0×10-2 mol/(Lmin),
=1.0×10-2 mol/(Lmin),
故答案为:1.0×10-2 mol/(Lmin);
(3)①由图可知,提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用),
故答案为:生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用);
②加入的固体A是MnSO4,
故答案为:MnSO4;
③提出的假设成立,应观察到的现象是与实验1比较,溶液褪色所需时间短 或所用时间(t)小于1.5min;
故答案为:与实验1比较,溶液褪色所需时间短 或所用时间(t)小于1.5min。


科目:高中化学 来源: 题型:
【题目】己烯雌酚是一种激素类药物,其结构简式如图所示。下列有关叙述中正确的是()

A.遇FeCl3溶液不能发生显色反应
B.可与NaOH和NaHCO3溶液发生反应
C.1mol该有机物可以与5molBr2发生反应
D.己烯雌酚分子中一定有16个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际奥委会公布的违禁药物有138种,其中某种兴奋剂分子结构如图,关于它的说法正确的是( )

A. 该物质属于芳香烃
B. 该分子中所有碳原子共面
C. 1mol该物质与氢氧化钠溶液完全反应,最多消耗2molNaOH
D. 该物质的化学式为C15H24ClNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)![]() C(g)+xD(g) ΔH>0,容器中A、B、D的物质的量随时间的变化如图所示。下列说法正确的是( )
C(g)+xD(g) ΔH>0,容器中A、B、D的物质的量随时间的变化如图所示。下列说法正确的是( )

A.反应前10min内反应的平均速率为v(D)=0.3mol·L-1·min-1
B.反应至15min时,其他条件不变,改变的条件可能是缩小容器体积
C.若平衡时保持温度不变,压缩容器体积,平衡逆向移动,平衡常数K值减小
D.反应至15min时,其他条件不变,改变的条件可能是降低反应体系温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在20 L的密闭容器中按物质的量之比1∶2充入CO和H2,发生:CO(g)+2H2(g) ![]() CH3OH(g) ΔH。测得CO的转化率随温度的变化及不同压强下CO转化率的变化、p2和195 ℃时n(H2)随时间的变化结果如图表所示。下列说法正确的是( )
CH3OH(g) ΔH。测得CO的转化率随温度的变化及不同压强下CO转化率的变化、p2和195 ℃时n(H2)随时间的变化结果如图表所示。下列说法正确的是( )
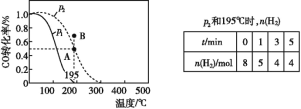
A.0~3 min,平均速率v(CH3OH)=0.8 mol·L-1·min-1
B.p1<p2,ΔH>0
C.在p2和195 ℃时,该反应的平衡常数为25( mol·L-1)-2
D.在B点时,v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:反应aA(g)+bB(g) ![]() cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
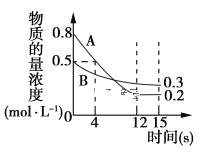
(1)从反应开始到12 s时,用A表示的反应速率为________。
(2)经测定前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为______________。
(3)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L-1·s-1;乙:v(B)=0.12 mol·L-1·s-1;丙:v(C)=9.6 mol·L-1·min-1;则甲、乙、丙三个容器中反应速率由快到慢的顺序为________。
(4)下表所列数据是反应CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)![]() H1在不同温度下的化学平衡常数(K)。
H1在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断![]() H1_______0(填“>”“=”或“<”);
H1_______0(填“>”“=”或“<”);
②某温度下,将2molCO和6molH2充入2L密闭容器,充分反应,达平衡后,测得c(CO)=0.2mol·L-1,则CO的转化率为__________,此时的温度为_______________从上表中选择)
(5)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
CH4(g)+3/2O2(g)![]() CO(g)+2H2O(g)
CO(g)+2H2O(g)![]() H=-519kJ·mol-1。工业上,为选择合适的催化剂,分别对X、Y、Z三 种催化剂进行了如下实验(其他条件相同)
H=-519kJ·mol-1。工业上,为选择合适的催化剂,分别对X、Y、Z三 种催化剂进行了如下实验(其他条件相同)
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1> T2> T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是__(填“X”、“Y”或“Z”)选择的理由是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是
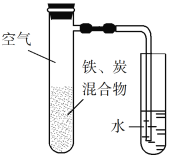
A. 铁被氧化的电极反应式为Fe3e![]() Fe3+
Fe3+
B. 铁腐蚀过程中化学能全部转化为电能
C. 活性炭的存在会加速铁的腐蚀
D. 以水代替NaCl溶液,铁不能发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
![]()
已知转化过程中的反应为2CrO42-(aq)+2H+(aq) ![]() Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有![]() 转化为Cr2O72-,下列说法不正确的是( )
转化为Cr2O72-,下列说法不正确的是( )
A.溶液颜色保持不变,说明上述可逆反应达到平衡状态
B.若用FeSO4作还原剂,处理1L废水,至少需要1.65mol
C.常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5
D.常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中的废镍催化剂(主要成分为NiCO3和SiO2,还含有少量Fe2O3、Cr2O3)为原料制备硫酸镍的工业流程如下:

已知:Ⅰ. NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物;
Ⅱ. Fe(OH)3不溶于NH4Cl—氨水的混合液,Ni(OH)2溶于NH4Cl—氨水的混合液生成[Ni(NH3)6]2+。
请回答下列问题:
(1)“酸溶”时应先将废镍催化剂粉碎,再与20%硫酸在100℃下反应2h,该操作的目的为____。
(2)“滤渣I”主要成分在工业上的用途为_______(只写1种即可),NH4Cl的电子式为_______。
(3)“一次碱析”时,加入的NaOH溶液需过量,含铬微粒发生反应的离子方程式为________。
(4)“氨解”的目的为_____________________。
(5)“氧化”时发生反应的离子方程式为___________________________。
(6)“二次碱浸”时,若使溶液中的Ni2+沉淀完全,则需维持c(OH-)不低于__________。(已知Ni(OH)2的Ksp=2×10-15,![]() ≈1.4)。
≈1.4)。
(7)“系列操作”具体是指____________、过滤、洗涤、干燥。若所得NiSO4·7H2O晶体不纯,应继续进行的提纯操作名称为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com