
下列说法正确的是:

A.电子从3S能级跃迁到3P能级形成的光谱是发射光谱 | B.白磷(P4)分子是正四面体结构,故分子中的键角为1090281 | C.NO2-中心原子采取sp2杂化,分子空间构型为“V”形 | D.原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
(2013?徐州模拟)某温度下,反应2A(g)
|
查看答案和解析>>
科目:高中化学 来源: 题型:
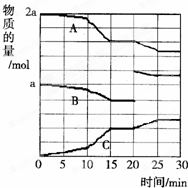 在实验室中做下列实验:把物质A、B按一定比例充入一个表面积为300cm2,容积为2L的球形容器,使压强为P,然后将整个容器用加热器加热到t℃时,发生如下反应:
在实验室中做下列实验:把物质A、B按一定比例充入一个表面积为300cm2,容积为2L的球形容器,使压强为P,然后将整个容器用加热器加热到t℃时,发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 1 | A | ||||||
| 2 | B | C | D | E | J | K | L |
| 3 | F | G | H | I | |||
| M |
 它的空间利用率为
它的空间利用率为查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 碳是形成化合物最多的元素.
碳是形成化合物最多的元素.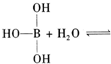
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com