
 人们对苯的认识有一个不断深化的过程.
人们对苯的认识有一个不断深化的过程.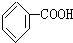 )和石灰的混合物得到液体,命名为苯,写出苯甲酸钠与NaOH共热生成苯的化学方程式:
)和石灰的混合物得到液体,命名为苯,写出苯甲酸钠与NaOH共热生成苯的化学方程式: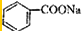 +NaOH$→_{△}^{氧化钙}$Na2CO3+
+NaOH$→_{△}^{氧化钙}$Na2CO3+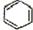 .
.
 )脱
)脱分析 (1)苯甲酸钠与碱石灰共热生成苯和碳酸钠;
(2)C6H6的一种含叁键且无支链链烃中含2个C≡C;苯不能使溴水褪色,但苯与液溴易发生取代反应;
(3)1,3-环己二烯(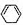 )脱去2mol氢原子变成苯却放热,苯的能量低,更稳定;
)脱去2mol氢原子变成苯却放热,苯的能量低,更稳定;
(4)若为苯的单、双键交替的正六边形平面结构,能与溴水发生加成、邻二溴苯有两种.
解答 解:(1)苯甲酸钠与碱石灰共热生成苯和碳酸钠,该反应为: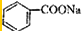 +NaOH$→_{△}^{氧化钙}$Na2CO3+
+NaOH$→_{△}^{氧化钙}$Na2CO3+ ,
,
故答案为: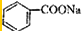 +NaOH$→_{△}^{氧化钙}$Na2CO3+
+NaOH$→_{△}^{氧化钙}$Na2CO3+ ;
;
(2)C6H6的一种含叁键且无支链链烃中含2个C≡C,其结构简式为HC≡C-C≡C-CH2CH3;苯不能使溴水褪色,但苯与液溴易发生取代反应,该反应为 ,
,
故答案为:HC≡C-C≡C-CH2CH3; ;
;
(3)1,3-环己二烯(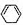 )脱去2mol氢原子变成苯却放热,苯的能量低,更稳定,则苯比1,3-环己二烯稳定,
)脱去2mol氢原子变成苯却放热,苯的能量低,更稳定,则苯比1,3-环己二烯稳定,
故答案为:稳定;
(4)若为苯的单、双键交替的正六边形平面结构,能与溴水发生加成、邻二溴苯有两种,但实际上不能与溴水发生加成,邻二溴苯有一种结构,不能解释,
故答案为:ad.
点评 本题考查有机物的结构与性质,侧重苯的结构与性质的考查,明确苯中化学键的特殊性是解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②④⑤⑥⑦ | C. | ②④⑤ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Y、Z、W形成的离子具有相同电子层结构,其离子半径依次增大 | |
| B. | 39g Z2Y2中含有的离子数约为1.204×1024 | |
| C. | 元素Z、R的氧化物的水化物之间相互反应生成的盐溶液一定呈中性 | |
| D. | 元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加成→取代→取代→取代 | B. | 取代→加成→取代→取代 | ||
| C. | 取代→取代→加成→取代 | D. | 取代→取代→取代→加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2SO4的酸性比H2CO3的强 | B. | Mg(OH)2的碱性比Ca(OH)2的弱 | ||
| C. | HCl、HBr、HI的热稳定性依次增强 | D. | 氯气比氟气更易与氢气发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
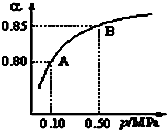
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
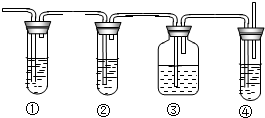 实验室里用乙醇和浓硫酸来制取乙烯:
实验室里用乙醇和浓硫酸来制取乙烯:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
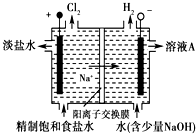 氯碱工业中电解饱和食盐水的原理示意图如图所示
氯碱工业中电解饱和食盐水的原理示意图如图所示查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度、温度、压强、催化剂既是影响反应速率的因素又是影响反应限度的因素 | |
| B. | 合成氨反应在一定条件下达到平衡后,N2、H2、NH3物质的量之比保持恒定 | |
| C. | 化学反应的限度决定于反应物的性质,与外界条件无关 | |
| D. | 增大反应物的用量一定会加快反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com