
【题目】(6分)将4molSO2与2molO2放入4L的密闭容器中,在一定条件下反应达到平衡:2SO2(g)+O2(g)![]() 2SO3(g) ,测得平衡时混合物总的物质的量为5mol,求:
2SO3(g) ,测得平衡时混合物总的物质的量为5mol,求:
(1)平衡时SO3的浓度;
(2)该温度下的平衡常数;
(3)平衡时SO2的转化率。
【答案】(共6分)(1) c(SO3)=0.5mol/L (2)K=4 (3)50% (各2分)
【解析】试题分析:(1)假设反应消耗的氧气的物质的量是x,则根据反应方程式2SO2(g)+O2(g)![]() 2SO3(g)可知,每有1mol氧气反应,反应后气体减小的物质的量是1mol。由于反应前气体的物质的量是6mol,反应后测得平衡时混合物总的物质的量为5mol,则减少1mol,所以反应消耗氧气1mol,消耗SO22mol,产生SO32mol,则平衡时SO3的浓度是c(SO3)= 2mol÷4L=0.5mol/L。(2)平衡时各种物质的浓度分别是c(SO2)= 4mol÷4L-0.5mol/L=0.5mol/L;c(O2)=" (2mol-1mol)" ÷4L=0.25mol/L;c(SO3)= 2mol÷4L=0.5mol/L。则该反应的化学平衡常数是
2SO3(g)可知,每有1mol氧气反应,反应后气体减小的物质的量是1mol。由于反应前气体的物质的量是6mol,反应后测得平衡时混合物总的物质的量为5mol,则减少1mol,所以反应消耗氧气1mol,消耗SO22mol,产生SO32mol,则平衡时SO3的浓度是c(SO3)= 2mol÷4L=0.5mol/L。(2)平衡时各种物质的浓度分别是c(SO2)= 4mol÷4L-0.5mol/L=0.5mol/L;c(O2)=" (2mol-1mol)" ÷4L=0.25mol/L;c(SO3)= 2mol÷4L=0.5mol/L。则该反应的化学平衡常数是![]() 。(3)平衡时SO2的转化率φ=(2mol÷4mol)×100%=50%。
。(3)平衡时SO2的转化率φ=(2mol÷4mol)×100%=50%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】阅读明代爱国诗人于谦的诗《石灰吟》,回答问题: 千锤万凿出深山,烈火焚烧若等闲.粉身碎骨浑不怕,要留清白在人间
(1)整首诗蕴含着石灰的来源、生产、性质、用途等多种化学事实,诗中所描述的变化共涉及到下列物质:①石灰石(主要成分CaCO3)②CaO③CO2④H2O⑤Ca(OH)2悬浊液⑥CaCO3 , 其中属于电解质的是(填序号)
(2)下列工业生产中一般不用石灰石作为原料的是(填序号) ①用海水为原料生产镁 ②制硅酸盐水泥 ③制普通玻璃 ④制漂白粉⑤制陶瓷
(3)零食包装袋中经常有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰,生石灰属于氧化物(填“酸性”或“碱性”),用方程式说明你的理由 .
(4)某兴趣小组同学对碳酸钙的制备进行了以下探究,该组同学使用大理石(含少量的Fe2O3杂质)等物质制备碳酸钙的实验流程如图: 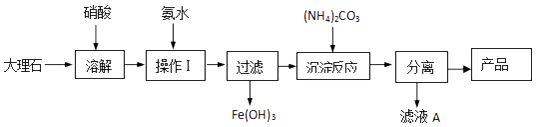 溶解大理石时,用硝酸而不用硫酸的原因是 , “滤液A”中除H+离子外,还含有的阳离子是;检验该阳离予的实验操作是 .
溶解大理石时,用硝酸而不用硫酸的原因是 , “滤液A”中除H+离子外,还含有的阳离子是;检验该阳离予的实验操作是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在 5L 的密闭容器中发生如下反应:N2 (g)+3H2 (g)2NH3(g),起初充入的 3.0mol N2 和 6.0mol H2 , 5 分钟后达到平衡,此时容器内压强是开始时的 ![]() ,问:
,问:
(1)氢气的平衡转化率为;
(2)用氨气表示 5min 内的反应速率为
(3)若要使氮气和氢气的平衡转化率相等,起始投料要求 n(H2 ):n(N2 )为
(4)以下措施能加快反应速率的是
A.缩小体积,使压强增大
B.恒温恒容充入 He 使压强增大
C.恒温恒压充入 He
D.平衡后加入催化剂
(5)如果利用此反应设计成原电池,并用稀硫酸做电解液,分别写出正、负极的电极反应 式:、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:mA(g)+nB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,且m+n_________p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率_________,B的转化率_________。
(4)若升高温度,则平衡时B、C的浓度之比 将_________。
(5)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______,而维持容器内压强不变,充入氖气时,混合物颜色_______(填“变深”“变浅”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.所有的电子在同一区域里运动
B.能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动
C.处于最低能量的原子叫基态原子
D.同一原子中,1s、2s、3s所能容纳的电子数越来越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去空气中的二氧化硫和氨氧化物气体对环境保护有重要意义。
(1)二氧化硫易溶于水,溶于水后所得溶液中H2SO3、HSO3-和SO32- 占三种粒子总数的比例随pH的变化如下图所示。由图可知H2SO3 的电离平衡常数Ka1=____________。
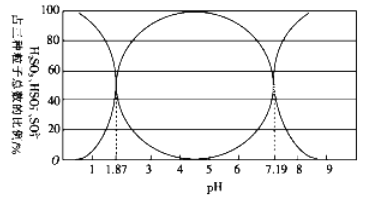
(2)利用尿素[CO(NH2)2]水解的溶液可以吸收含SO2 的空气。已知尿素水解放热,常温下水解反应较慢,水解的反应方程式如下:CO(NH2)2+H2O=H2NCOONH4(氨基甲酸铵)。
①氨基甲酸铵会与空气中的SO2 和O2 反应生成(NH4)2SO4,该反应的化学方程式为__________。
②一定条件下,用尿素溶液吸收含SO2 的空气,测得SO2 的吸收率随溶液的温度变化如图甲所示。温度高于60 ℃时,SO2 的吸收率逐渐升高的原因是_____________。
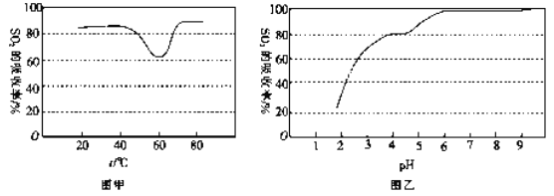
③尿素溶液吸收SO2 的吸收率随溶液的pH变化如图乙所示。尿素溶液吸收含SO2的空气后溶液的pH会降低,为提高SO2 的吸收率和充分回收产物,最好向溶液中加入_____(填溶液的名称)并控制pH 为_______。
(3)一种电化学脱硝法的原理如图所示。
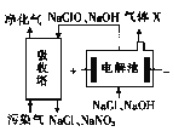
①电解池阴极所发生的电极反应为_____________。
②相同条件下通入的污染气和生成的X 的体积比为40 :3,污染气中NO 和NO2 占总体积的10%,若NaClO完全反应,污染气中NO和NO2 被完全吸收且其余气体不参与反应,则NO和NO2 的体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的用途错误的是
A. 水玻璃可用作木材防火剂
B. 二氧化硅是制造光导纤维的材料
C. 石英是制造太阳能电池的常用材料
D. 石灰石和纯碱均是生产普通玻璃的原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某同学为探究元素周期表中同周期元素性质的递变规律,设计了如下系列实验.
(1)将钠、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:与盐酸反应最剧烈,与盐酸反应产生的气体最多.
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为 .
(3)干燥管D的作用是 .
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4 , (KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液的现象,即可证明.从环境保护的观点考虑,此装置缺少尾气处理装置,可用溶液吸收尾气.
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液的现象,即可证明.但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有溶液的洗气瓶. 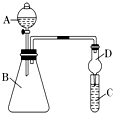
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1mol/L二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数![]() 随pH的变化如图所示[已知
随pH的变化如图所示[已知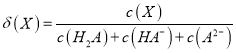 ]。
]。
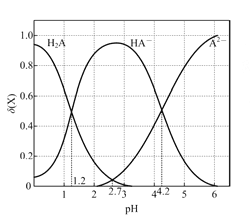
下列叙述错误的是
A. pH=1.2时,c(H2A)=c(HA-)
B. lg[K2(H2A)]=-4.2
C. pH =2.7时,c(HA-)>c(H2A)=c(A2-)
D. pH=4.2时,c(HA-)=c(A2-)=c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com