
【题目】利用含H2S的废气可回收硫,既可以保护环境又可资源化利用。回答下列问题:
(1)将H2S直接分解回收硫的同时得到氡能源的技术具有发展远景。起始时在反应器中充入一定量的H2S,在一定条件下发生反应2H2S(g)![]() 2H2 (g)+S2(g),H2S热分解温度与平衡时气体组成如图所示:
2H2 (g)+S2(g),H2S热分解温度与平衡时气体组成如图所示:

①反应2H2S(g)![]() 2H2(g)+S2(g)的△H=___________0(填“>”或“<”)
2H2(g)+S2(g)的△H=___________0(填“>”或“<”)
②图中A点H2S的分解率为___________(保留3位有效数字)
③若B点容器内气体总压为PPa,则此时反应的平衡常数Ka=___________Pa(Kp为以分压表示的平衡常数,列出含P的代数式)。
(2)Fe3+溶液脱除H2S的原理如图所示:

①吸收塔中发生反应的化学方程式为___________。
②电解槽中再生FeCl3的原理是(结合方程式说明)___________。
③电解槽中的“交换膜”为___________(填“阴离子”“阳离子”或“质子”)交换膜。
(3)H2S和空气按一定流速通入酸性FeCl3溶液,可实现空气脱硫得到单质硫。FeCl3溶液吸收H2S过程中,溶液中的n(Fe3+)、被吸收的n(H2S)随时间t的变化如图。

①t1以后,溶液中n(Fe3+)保持基本不变,原因是___________。
②t1以后的溶液中总反应方程式可以表示为___________。
【答案】> 66.7% ![]() P 2FeCl3+H2S=2 FeCl2+S↓+2HCl 阳极发生电极反应Fe2+-e-= Fe3+(或2Cl--2e-=Cl2,Cl2+2Fe2+=2Cl-+2Fe3+),使c(Fe3+)升高,使FeCl3再生 质子 t1以后溶液中同时发生两个反应,Fe3+氧化吸收H2S和Fe2+被O2氧化再生Fe3+,当两个反应速率相等时,溶液中n(Fe3+)保持基本不变 2H2S+ O2
P 2FeCl3+H2S=2 FeCl2+S↓+2HCl 阳极发生电极反应Fe2+-e-= Fe3+(或2Cl--2e-=Cl2,Cl2+2Fe2+=2Cl-+2Fe3+),使c(Fe3+)升高,使FeCl3再生 质子 t1以后溶液中同时发生两个反应,Fe3+氧化吸收H2S和Fe2+被O2氧化再生Fe3+,当两个反应速率相等时,溶液中n(Fe3+)保持基本不变 2H2S+ O2![]() 2 S↓+2H2O
2 S↓+2H2O
【解析】
(1)①升温平衡正向移动,则正反应为吸热反应,△H>0;
②图中A点n(H2S)=n(S2),列出三段式,找出平衡时H2S的转化量,根据分解率计算公式计算;
③图中A点n(H2S)=n(H2),列出三段式,找出平衡时各组分的分压,再根据Ka=![]() 计算;
计算;
(2)①由图可知,吸收塔中FeCl3和H2S反应生成FeCl2、S和HCl;
②通过电解将FeCl2转化为FeCl3,其原理是阳极发生电极反应Fe2+-e-= Fe3+(或2Cl--2e-=Cl2,Cl2+2Fe2+=2Cl-+2Fe3+),使c(Fe3+)升高,使FeCl3再生;
③电解时进入阳极室的H+要在阴极得电子,所以“交换膜”为质子交换膜。
(3) ①由图可知,t1前n(Fe3+)迅速减小、被吸收的n(H2S)显著增加,发生的反应为2FeCl3+H2S=2 FeCl2+S↓+2HCl;t1以后溶液中同时发生两个反应,Fe3+氧化吸收H2S和Fe2+被O2氧化再生Fe3+,当两个反应速率相等时,溶液中n(Fe3+)保持基本不变;
②t1以后Fe3+起催化作用,总反应方程式可以表示为2H2S+ O2![]() 2 S↓+2H2O。
2 S↓+2H2O。
(1)①由图可知,随着温度升高,混合物中H2S的含量减少,H2和S2的含量增加,说明升温平衡正向移动,则正反应为吸热反应,△H>0,
②图中A点n(H2S)=n(S2),设起始时有1mol H2S,A点达到平衡时有2x mol H2S发生分解,则:
2H2S(g)![]() 2H2 (g)+S2(g)
2H2 (g)+S2(g)
起始量 1 0 0
转化量 2x 2x x
平衡量 1-2x 2x x
1-2x=x,解得:x=![]() ,
,
H2S的分解率为![]() ×100%= 66.7%,
×100%= 66.7%,
③图中A点n(H2S)=n(H2),设起始时有1mol H2S,A点达到平衡时有2y mol H2S发生分解,则:
2H2S(g)![]() 2H2 (g)+S2(g)
2H2 (g)+S2(g)
起始量 1 0 0
转化量 2y 2y y
平衡量 1-2y 2y y
1-2y=2y,解得:y=![]() ,H2S、H2和S2的物质的量分数分别为:0.4、0.4和0.2,
,H2S、H2和S2的物质的量分数分别为:0.4、0.4和0.2,
平衡常数Ka=![]() =
=![]() =0.2Pa=
=0.2Pa=![]() P。
P。
因此,本题正确答案是:> ;66.7%;![]() P。
P。
(2)①由图可知,吸收塔中FeCl3和H2S反应生成FeCl2、S和HCl,化学方程式为2FeCl3+H2S=2 FeCl2+S↓+2HCl;
②通过电解将FeCl2转化为FeCl3,其原理是阳极发生电极反应Fe2+-e-= Fe3+(或2Cl--2e-=Cl2,Cl2+2Fe2+=2Cl-+2Fe3+),使c(Fe3+)升高,使FeCl3再生;
③电解时进入阳极室的H+要在阴极得电子,所以“交换膜”为质子交换膜;
因此,本题正确答案是:2FeCl3+H2S=2 FeCl2+S↓+2HCl;阳极发生电极反应Fe2+-e-= Fe3+(或2Cl--2e-=Cl2,Cl2+2Fe2+=2Cl-+2Fe3+),使c(Fe3+)升高,使FeCl3再生;质子。
(3) ①由图可知,t1前n(Fe3+)迅速减小、被吸收的n(H2S)显著增加,发生的反应为2FeCl3+H2S=2 FeCl2+S↓+2HCl;t1以后溶液中同时发生两个反应,Fe3+氧化吸收H2S和Fe2+被O2氧化再生Fe3+,当两个反应速率相等时,溶液中n(Fe3+)保持基本不变;
②t1以后Fe3+起催化作用,总反应方程式可以表示为2H2S+ O2![]() 2 S↓+2H2O,
2 S↓+2H2O,
因此,本题正确答案是:t1以后溶液中同时发生两个反应,Fe3+氧化吸收H2S和Fe2+被O2氧化再生Fe3+,当两个反应速率相等时,溶液中n(Fe3+)保持基本不变;2H2S+ O2![]() 2 S↓+2H2O。
2 S↓+2H2O。


科目:高中化学 来源: 题型:
【题目】向容积为2 L的密闭容器中加入足量活性炭和NO,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g),△H<0,NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),△H<0,NO和N2的物质的量变化如下表所示。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
请回答下列问题:
(1) 0—5 min内,以CO2表示的该反应速率v(CO2)=____,该条件下的平衡常数K=____。
(2) 第15 min后,温度调整到T2,数据变化如上表所示,则T1___T2(填“>”、“<”或“=” )。
(3)若30 min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则该可逆反应最终达平衡时NO的转化率α=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据水解反应离子方程式的书写原则及其注意的问题,判断下列选项正确的是( )
A. FeCl3+3H2O===Fe(OH)3↓+3HCl
B. Al2S3+6H2O![]() 2Al(OH)3+3H2S
2Al(OH)3+3H2S
C. S2-+2H2O![]() H2S+2OH-
H2S+2OH-
D. HCO3-+H2O![]() H2CO3+OH-
H2CO3+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列盐溶液水解的离子方程式
(1)次氯酸钾(KClO)溶液__________________________________________________;
(2)磷酸钠(Na3PO4)溶液___________________________________________________;
(3)明矾净水水解原理____________________________________________;
(4)硫酸铁溶液__________________________________________
(5)泡沫灭火器的原理__________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语书写错误的是
A. 2Al+6H+→2Al3++3H2↑B. HCO3- +OH-→CO32- +H2O
C. 2Fe2++Cl2→2Fe3++2Cl-D. CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2气体分别通入下列四种溶液中,有关现象及结论的说法正确的是

A. 试管①中有淡黄色沉淀生成,说明SO2有氧化性
B. 试管②中溶液褪色,说明SO2有漂白性
C. 试管③中能产生白色沉淀,说明SO2有酸性
D. 试管④中溶液颜色变浅,说明SO2有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔可以二聚也可以三聚。以乙炔为原料在不同的反应条件下转化,可以合成氯丁橡胶和对羟基苯甲酸。
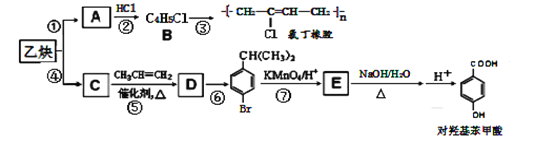
完成下列问题:
(1)写出A的分子式____,E中官能团名称___、___(苯环除外),D的结构简式____。
(2)上述反应中,指出②的反应类型____;反应⑥所需的反应试剂及反应条件_____。
(3)E的同分异构体,满足苯环上有两个取代基,有____种。
(4)写出反应③的化学方程式_________。
(5)设计一条由(CH3)2C=CH2合成 的路线。_______
的路线。_______
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香烃的分子式为C9H12,已知苯环上的一氯取代物只有两种,下列说法中正确的是
A. 该有机物不能发生取代反应,但能发生加成反应
B. 该有机物不能使酸性高锰酸钾溶液褪色,但能使溴水褪色
C. 该有机物分子中的所有原子可能在同一平面上
D. 该有机物的一氯取代物最多有5种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com