
X、Y、Z、W四种常见元素,其中X、Y、Z为短周期元素。有关信息如下表:
|
|
原子或分子相关信息 |
单质及其化合物相关信息 |
|
X |
ZX4分子是由粗Z提纯Z的中间产物 |
X的最高价氧化物对应的水化物为无机酸中最强酸 |
|
Y |
Y原子的最外层电子数等于电子层数 |
Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料 |
|
Z |
Z原子的最外层电子数是次外层电子数的1/2 |
Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料 |
|
W |
W原子的最外层电子数小于4 |
W的常见化合价有+3、+2,WX3稀溶液呈黄色 |
(1)W在周期表的位置为 ,W(OH)2在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为 。
(2)X的简单阴离子的结构示意图为 ,X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为 。
(3)Z的氧化物在通讯领域用来作 ,工业上制备Z的单质的化学反应方程式为 。锗与Z是同一主族元素,门捷列夫曾预言了这一元素的存在,它用来制造半导体晶体管,最新研究表明:有机锗具有明显的抗肿瘤活性,锗不与NaOH 溶液反应但在有H2O2 存在时可与NaOH 溶液反应生成锗酸盐,其方程式为 。
(4)在50 mL l mol·L-1的YX3溶液中逐滴加入0.5 mol·L-1的NaOH溶液,得到1.56 g沉淀,则加入NaOH溶液的体积最多为 mL。
(1)第四周期 VIII族 4Fe(OH)2+O2+2H2O== 4Fe(OH)3
(2)
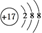 6H++Al2O3=2Al3++3H2O
(3)光导纤维 SiO2+2C
6H++Al2O3=2Al3++3H2O
(3)光导纤维 SiO2+2C Si+2CO↑ Ge+2 H2O2+2NaOH=Na2GeO3 +3H2O (4)360
Si+2CO↑ Ge+2 H2O2+2NaOH=Na2GeO3 +3H2O (4)360
【解析】
试题分析:(1)根据题意可知:X是氯;Y是铝;Z是硅;W是铁。铁在所以周期表中位于第四周期第Ⅷ族。氢氧化亚铁在空气中被氧化的方程式是 4Fe(OH)2+O2+2H2O==
4Fe(OH)3 (2)Cl-离子的结构示意图是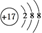 。氧化铝是两性氧化物,既能与强酸反应又能与强碱反应生成盐和水。高氯酸与氧化铝反应的离子方程式是:6H++Al2O3=2Al3++3H2O
(3)SiO2广泛用作光导纤维。工业上制备单质硅的化学反应方程式是:SiO2+2C
。氧化铝是两性氧化物,既能与强酸反应又能与强碱反应生成盐和水。高氯酸与氧化铝反应的离子方程式是:6H++Al2O3=2Al3++3H2O
(3)SiO2广泛用作光导纤维。工业上制备单质硅的化学反应方程式是:SiO2+2C Si+2CO↑ 锗在有H2O2存在时可与NaOH 溶液反应生成锗酸盐,其方程式为Ge+2 H2O2+2NaOH=Na2GeO3+3H2O (4)AlCl3+3NaOH=Al(OH)3↓+3NaCl。Al(OH)3++NaOH=NaAlO2+2H2O。n(AlCl3)=0.05mol,n(Al(OH)3)=m/M=1.56
g÷78g/mol=0.02mol.n(AlCl3)>n(Al(OH)3).沉淀没有达到最大值,一种情况是加入的氢氧化钠不足量,另一种情况是加入的氢氧化钠过量,溶解了一部分产生氢氧化铝沉淀。加入NaOH溶液的体积最多时是第二种情况n(NaOH)=4n(AlCl3)-n(Al(OH)3)=4×0.05mol-0.02mol=0.18mol.所以氢氧化钠的体积是V=n/C=0.18mol÷0.5 mol·L-1=0.36L=360ml.
Si+2CO↑ 锗在有H2O2存在时可与NaOH 溶液反应生成锗酸盐,其方程式为Ge+2 H2O2+2NaOH=Na2GeO3+3H2O (4)AlCl3+3NaOH=Al(OH)3↓+3NaCl。Al(OH)3++NaOH=NaAlO2+2H2O。n(AlCl3)=0.05mol,n(Al(OH)3)=m/M=1.56
g÷78g/mol=0.02mol.n(AlCl3)>n(Al(OH)3).沉淀没有达到最大值,一种情况是加入的氢氧化钠不足量,另一种情况是加入的氢氧化钠过量,溶解了一部分产生氢氧化铝沉淀。加入NaOH溶液的体积最多时是第二种情况n(NaOH)=4n(AlCl3)-n(Al(OH)3)=4×0.05mol-0.02mol=0.18mol.所以氢氧化钠的体积是V=n/C=0.18mol÷0.5 mol·L-1=0.36L=360ml.
考点:考查元素的推断及氧化铝、氢氧化铝的两性等知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相同 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
查看答案和解析>>
科目:高中化学 来源:2014届安徽省高三上学期第一次联考化学试卷(解析版) 题型:选择题
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
|
元素 |
相关信息 |
|
X |
啤酒和饮料中常溶有X的最高价氧化物,打开瓶子时,这种氧化物会大量逸出 |
|
Y |
Y2是空气中含量最高的气体单质 |
|
Z |
Z的基态原子最外层电子排布式为2s22p4 |
|
W |
W的一种核素质量数为27,中子数为14 |
(1)W位于元素周期表第 周期第 族;Z和W的最简单的离子半径大小关系为
(用离子符号表示)
(2)一种X形成的单质,是自然界硬度最大的物质,若熔化这种单质,所需克服的微粒间的作用力是 ;Y的电负性比Z (填“大”或“小”)
(3)W的单质与NaOH溶液反应的离子方程式为 , W在高温条件下可还原高熔点的金属氧化物制的金属单质,写出W还原Cr2O3反应的化学方程式: 。
(4)煤燃烧产生的烟气中有Y的氧化物,会引起严重的环境问题,因此,常用XH4催化还原以消除污染,已知:
XH4(g)+2 YO2(g)== Y2(g)+ XO2(g)+2H2O (g) △H1= -867kJ/mol
2 YO2(g)  Y2O4(g)
△H2=-56.9kJ/mol
Y2O4(g)
△H2=-56.9kJ/mol
查看答案和解析>>
科目:高中化学 来源:2013届河南周口重点高中四校高二下学期第一次联考化学卷(解析版) 题型:推断题
(11分)X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
|
元素 |
相关信息 |
|
X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
|
Y |
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
|
Z |
Z和Y同周期,Z的电负性大于Y |
|
W |
W的一种核素的质量数为63,中子数为34 |
(1)Y的元素符号是
(2)XY2是一种常用的溶剂,XY2的分子中存在 个σ键,中心原子杂化轨道类型 ;在H―Y、H―Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(3)W的基态原子核外电子排布式是 。
(4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y。此反应的化学方程式是 。
(5)请设计一个实验方案,比较Y、Z单质氧化性的强弱:
_____________________________________________________________________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com