
| A. | v(A)=0.5mol•L-1•mim-1 | B. | v(B)=0.3mol•L-1•mim-1 | ||
| C. | v(C)=0.8mol•L-1•mim-1 | D. | v(D)=0.1mol•L-1•s-1 |
分析 根据反应方程式,把不同物质的反应速率换算成同一物质的反应速率且单位相同进行比较.
解答 解:同一化学反应中,同一时间段内,化学反应速率之比等于计量数之比.
A、υ(A)=0.5mol•L-1•mim-1;
B、υ(B)=0.3mol•L-1•mim-1,所以υ(A)=0.6mol•L-1•mim-1;
C、υ(C)=0.8mol•L-1•mim-1,所以υ(A)=$\frac{1.6}{3}$mol/(L•min);
D、υ(D)=0.1mol/(L•s),所以υ(A)=6mol/(L•min);
所以表示该反应速率最快的是D.
故选D.
点评 本题考查学生对化学反应速率及其表示法的理解及应用,解题方法是:把不同物质的反应速率换算成同一物质的反应速率进行比较,注意单位是否相同.


科目:高中化学 来源: 题型:多选题
| A. | 偏二甲肼既是氧化剂又是还原剂 | |
| B. | 该反应进行时只有放热过程没有吸热过程 | |
| C. | 该反应中氮元素的化合价升高 | |
| D. | 该反应中每生成1mol CO2转移8mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C-O键的极性比N-O键的极性大 | |
| B. | CO和N2互为等电子体,且N2的沸点比CO的高 | |
| C. | H2CO3、H2SiO3、H3PO4酸性越来越弱 | |
| D. | 金属K采用面心立方堆积,空间利用率为74% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1H和2H是不同的核素,它们的中子数相同 | |
| B. | 6Li和7Li的质子数相等,电子数也相等 | |
| C. | 14C和14N的质子数不等,它们的中子数相等 | |
| D. | 13C和14C属于同一种元素,它们的质量数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、X、Y、Z原子的核外最外层电子数的总和为22 | |
| B. | W与Y可形成既含极性共价键又含非极性共价键的化合物 | |
| C. | 有W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 | |
| D. | 上述四种元素的原子半径大小为W<X<Y<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工作时Zn 电极质量减少 | B. | Zn 是负极,Ag2O 是正极 | ||
| C. | 工作时溶液中电子由Ag2O 流向Zn | D. | 溶液中氢氧根离子向Zn 电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
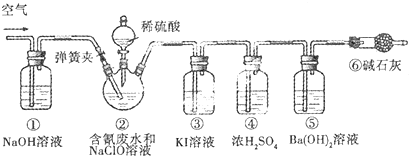

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
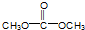 简称DMC)是油漆、胶粘剂行业的环保型绿色溶剂.DMC的合成方法很多,如以乙烯为原料,与甲醇进行酯交换的合成路线如下:
简称DMC)是油漆、胶粘剂行业的环保型绿色溶剂.DMC的合成方法很多,如以乙烯为原料,与甲醇进行酯交换的合成路线如下: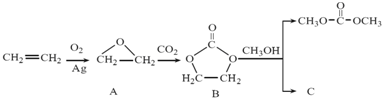

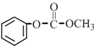 ;
;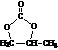 的合成路线(注明必要的反应条件)
的合成路线(注明必要的反应条件)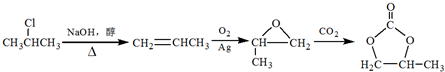 .合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物.
.合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com