
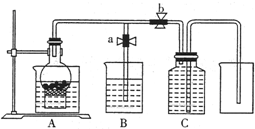
 ijͬѧ�����ͼ��ʾװ���������ô�������ijŨ��ϡ���ᷴӦ��ȡNO���壮
ijͬѧ�����ͼ��ʾװ���������ô�������ijŨ��ϡ���ᷴӦ��ȡNO���壮
|
������Һ�е������Ӽ������ʵ��� | ||||
��
|
|||||
=
|
a mol Fe3+ | ||||
����
|
|||||
=
|
a mol Fe2+ | ||||
��
|
| a |
| b |
| 1 |
| 4 |
| a |
| b |
| 1 |
| 4 |
| a |
| b |
| 1 |
| 4 |
| 3 |
| 8 |
|
| 3b |
| 4 |
| 3b |
| 4 |
| a |
| b |
| 3 |
| 8 |
| a |
| b |
| 3 |
| 8 |
| 3b |
| 8 |
|
������Һ�е������Ӽ������ʵ��� | ||||||||
��
|
a mol Fe3+ ��b-4a��mol H+ | ||||||||
=
|
a mol Fe3+ | ||||||||
����
|
��
| ||||||||
=
|
a mol Fe2+ | ||||||||
��
|
|



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������������е���Ԫ��ʱ�����������NaOH��Һ��ϼ��Ⱥ�����ϡ��������ữ���ټ���AgN03��Һ���м��� |
| B��Ϊ�˼ӿ�����ٶ��Լ��õ��ϸ���Ĺ����ɫ��״�������Բ��ó��˵ķ��� |
| C��ͨ�����ò������ݵĿ��������Ƚϲ�ͬ������Na2S2O3��Һ��ϡ����ķ�Ӧ���� |
| D��������Һ�������棬���ú���ɵ����������ױ�ը |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ڰ�ˮ�м���������ˮ���Ȼ�粒������ʹ��Һ�е�c��OH-����С |
| B����ӦHg��l��+H2SO4��aq���THgSO4��aq��+H2��g���ڳ����²����Է����У����H��0 |
| C����ҵ���ʳ��ˮ�У����ر������ӽ���Ĥ���������Һ������ң�Ŀ���DZ��������������������ռӦ |
| D���ڵ�Ũ�ȵ�NaCl��Na2CrO4ϡ��Һ�еμ�AgNO3��Һ��������AgCl��������Ksp��AgCl����Ksp��Ag2CrO4�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
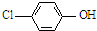 ���ķ�ˮ�������������س�ȥ����ԭ����ͼ1��ʾ��
���ķ�ˮ�������������س�ȥ����ԭ����ͼ1��ʾ��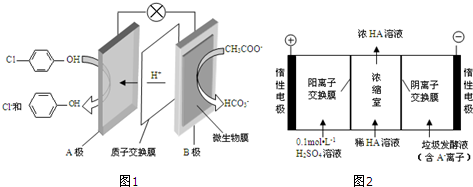
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
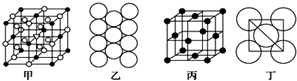
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��c��OH-��=c��Na+����c��HCOO-����c��H+�� |
| B��c��Na+��=c��HCOO-�� |
| C��c��Na+����c��HCOO-����c��OH-����c��H+�� |
| D��c��H+����c��HCOO-����c��Na+����c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ľ̿��Ũ���� |
| B��ͭ��ϡ���� |
| C��п��ϡ���� |
| D��ľ̿��Ũ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����pH=0����Һ�У�Cl-��Na+��K+��C6H5-O-��C6H5һΪ������ |
| B��������м�������ų�����Һ�У�NH4+��K+��HCO3-��Br- |
| C����H2SO3��Һ�У�HSO3-��K+��Cl-��Ba2+ |
| D���������ǣ�C6H12O6����Һ�У�SO42-��MnO4-��K+��H+ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com