

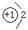 (1分)
(1分) 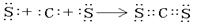 (2分)
(2分) NaClO+H2↑ (2分)
NaClO+H2↑ (2分)  NaClO+H2↑。
NaClO+H2↑。

科目:高中化学 来源:不详 题型:填空题
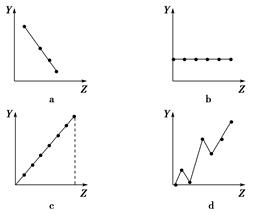
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Li、Be、B原子最外层电子数依次增多 |
| B.P、S、Cl元素最高正价依次升高 |
| C.N、O、F原子半径依次增大 |
| D.Na、K、Rb的电子层数逐渐增多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径:乙>丁>丙 |
| B.非金属性:丙>丁>戊 |
| C.甲与戊形成的化合物是共价化合物 |
| D.乙、丙、丁最高价氧化物对应的水化物均是强酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
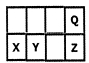
| A.最高价氧化物对应水化物的酸性Z>Y |
| B.原子半径X>Y |
| C.一定条件下,Q可分别与X、Y、Z形成化合物,这些化合物都可溶于NaOH溶液 |
| D.元素Y的氧化物是形成酸雨的罪魁祸首 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.第三周期ⅣA族 | B.第三周期ⅢA族 |
| C.第四周期ⅣA族 | D.第四周期ⅣB族 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.仅③ | B.①③ | C.②④ | D.②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com