
| A. | 3.0 g | B. | 5.4g | C. | 6 g | D. | 无法确定 |
分析 发生C+O2$\frac{\underline{\;高温\;}}{\;}$CO2、2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO,由方程式可知只发生前者则压强与原来的相同,只发生后者则压强是原来的2倍;测得容器内的压强变为原来的1.8倍,说明上述两反应发生,即生成CO2和CO的混合物,以此来解答.
解答 解:n(O2)=$\frac{8g}{32g/mol}$=0.25mol,反应后容器内的压强变为原来的1.8倍,则CO2和CO的混合物的物质的量为0.25mol×1.8=0.45mol,由C原子守恒可知,参加反应的碳的质量为0.45mol×12g/mol=5.4g,
故选B.
点评 本题考查化学反应的计算,为高频考点,把握发生的反应、物质的量与压强的关系、原子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只能是同种物质 | B. | 一定是同系物,有相同的通式 | ||
| C. | 实验式一定相同 | D. | 一定互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
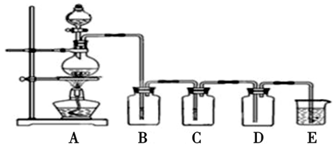
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{w(A+x-n)}{A}$mol | B. | $\frac{A(A-x+n)}{w}$mol | C. | $\frac{w(A-x-n)}{A}$mol | D. | $\frac{w(A+x+n)}{A}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-lKNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+,Na+、SO42- | |
| C. | 0.1 mol•L-1 FeCl3溶液:K+、NH4+、Cl-、S2- | |
| D. | 在无色透明溶液中:Ba2+、Ca2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
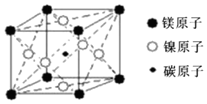
| A. | MgCNi3 | B. | MgC2Ni | C. | MgCNi2 | D. | Mg2CNi3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com