






 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
| 甲 | 乙 | 丙 | |
| 分子 比例模型 |
 |
 |
 |
| 物质性质 | 地球上最常见的物质,是组成生物体的重要物质之一,约占人体质量的2/3. | 无色,无气味并且易燃.是常见的一种基础能源. | 有强氧化性的弱酸,可以用于消毒杀菌. |


查看答案和解析>>
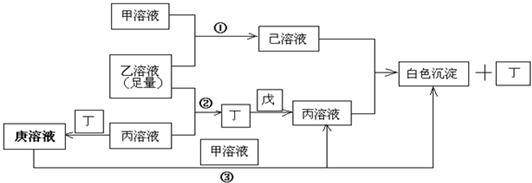
科目:高中化学 来源: 题型:




查看答案和解析>>
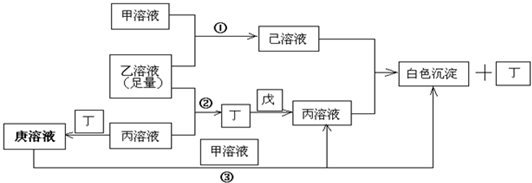
科目:高中化学 来源: 题型:
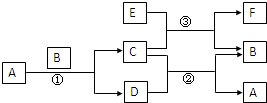 右图中所涉及的A、B、C、D、E、F和G都是中学化学教材中常见的物质.E为铝;B、D为单质,其余为化合物;反应①②③均在高温下进行且均为置换反应;A在常温下为液态,C有磁性,E、F既能溶于NaOH又能溶于HCl.
右图中所涉及的A、B、C、D、E、F和G都是中学化学教材中常见的物质.E为铝;B、D为单质,其余为化合物;反应①②③均在高温下进行且均为置换反应;A在常温下为液态,C有磁性,E、F既能溶于NaOH又能溶于HCl.
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com