
| A. | 己烷和苯 | B. | 乙烯和乙炔 | C. | 乙醇和乙醛 | D. | 甲苯和苯 |
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案科目:高中化学 来源: 题型:选择题

| A. | 该铅蓄电池正在充电 | |
| B. | 工作一段时间后,溶液的pH不断减小 | |
| C. | a为铅蓄电池的正极 | |
| D. | b电极发生的反应为PbO2+4H++SO42-+2e-═PbSO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 通过电解饱和食盐水得到的氢氧化钠固体样品常含有氯化钠杂质.来来同学利用中和滴定原理测定氢氧化钠的质量分数.步骤为:
通过电解饱和食盐水得到的氢氧化钠固体样品常含有氯化钠杂质.来来同学利用中和滴定原理测定氢氧化钠的质量分数.步骤为:| 实验序号 | 待测样品溶液体积(mL) | 滴定管读数 | 消耗标准盐酸溶液的体积(mL) | |
| 初读数 | 末读数 | |||
| 1 | 20.00 | 0.00 | 19.95 | 19.95 |
| 2 | 20.00 | 0.05 | 19.90mL | 19.85mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极 被还原 | B. | 正极 被氧化 | C. | 负极 被还原 | D. | 负极 被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、NO3-、OH-、Cl- | B. | H+、Ba2+、Ag+、Cl- | ||
| C. | Fe2+、Fe3+、Na+、NO3- | D. | Ca2+、H+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 现代元素周期表是按照元素相对原子质量由小到大排列而成的 | |
| B. | 同主族的元素,都是按从上到下的顺序电子层数逐渐增多 | |
| C. | 同周期的元素,都是按从左到右的顺序原子最外层电子数由1递增到8 | |
| D. | 同周期的元素的原子和离子半径,都是按从左到右的顺序逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
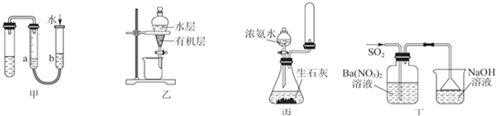
| A. | 用图甲的方法不能检查此装置的气密性 | |
| B. | 图乙可以作为CCl4萃取溴水后的分液装置 | |
| C. | 实验室用图丙所示装置制取少量氨气 | |
| D. | 图丁洗气瓶中的白色沉淀为BaSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
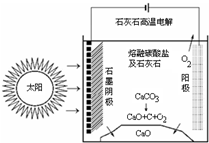 CO2是合成尿素的原料,但水泥厂生产时却排放出大量的CO2.华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:
CO2是合成尿素的原料,但水泥厂生产时却排放出大量的CO2.华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
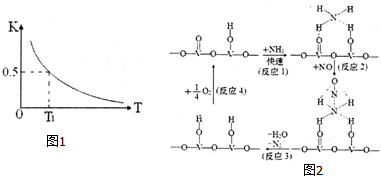 环境污染影响人类生存,治理污染是化学工作者研究的重要课题.
环境污染影响人类生存,治理污染是化学工作者研究的重要课题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com