
| A. | 在0.1 mol•L-1FeCl3溶液中,Na+、NH4+、HCO3-、ClO-一定大量共存 | |
| B. | 常温下,某溶液中由水电离出的c(H+)=1×10-amol•L-1,则该溶液一定pH=a | |
| C. | 相同物质的量浓度下列溶液:①NH4Al(SO4)2;②NH4Cl;③CH3COONH4;④NH3•H2O.其中c(NH4+)由大到小的顺序是①>②>③>④ | |
| D. | AgCl悬浊液中存在如下平衡:AgCl(s)?Ag+(aq)+Cl-(aq).向其中加入少量NaCl晶体,平衡逆向移动,故AgCl溶解度减少,溶度积Ksp也减少 |
分析 A.铁离子与碳酸氢根离子、次氯酸根离子发生双水解反应;
B.若a<7,则促进水电离,该溶液为盐溶液,溶液的pH=a;如果a>7,则抑制水电离,该溶液为酸溶液或碱溶液,则该溶液的PH值为a或14-a;
C.①铝离子水解抑制铵根离子的水解,②铵根离子水解,③醋酸根离子水解促进铵根离子水解,④弱碱电离,且电离的程度很弱;
D.溶度积常数与温度有关系,与溶液类型以及浓度无关.
解答 解:A.HCO3-、ClO-与FeCl3发生双水解反应,在溶液中不能大量共存,故A错误;
B.常温下,某溶液中由水电离出的c(H+)=1×10-amol•L-1,如果a<7,则促进水电离,该溶液为盐溶液,溶液的pH=a;如果a>7,则抑制水电离,该溶液为酸溶液或碱溶液,则该溶液的PH值为a或14-a,故B错误;
C.同浓度的下列溶液:①NH4Al(SO4)2②NH4Cl③CH3COONH4,④NH3•H2O,因①中铝离子水解抑制铵根离子的水解;②中铵根离子水解;③醋酸根离子水解促进铵根离子水解,④弱碱电离,且电离的程度很弱,则c(NH4+)由大到小的顺序是:①>②>③>④,故C正确;
D.向其中加入少量NaCl晶体,由于氯离子浓度增大,则平衡逆向移动,故AgCl溶解度减少,由于温度不变,则溶度积Ksp不变,故D错误;
故选C.
点评 本题考查了离子浓度大小比较、离子共存、难溶物溶度积的应用等知识,题目难度中等,试题知识点较多,充分考查了学生的分析、理解能力及灵活应用能力,注意掌握离子共存的判断方法,明确难溶物溶度积的含有及其应用.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某元素的原子最外层电子数是次外层电子数的两倍,该元素是碳;它在元素周期表中的位置是第二周期第ⅣA族;该元素和氢元素组成的某种有机物是“西气东输”中“气”的主要成分,这种有机物的电子式为
某元素的原子最外层电子数是次外层电子数的两倍,该元素是碳;它在元素周期表中的位置是第二周期第ⅣA族;该元素和氢元素组成的某种有机物是“西气东输”中“气”的主要成分,这种有机物的电子式为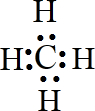 ;结构式
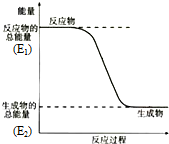
;结构式 ;空间构型:正四面体.这种化合物中碳元素的质量分数为75%.该物质在氧气中充分燃烧的反应方程式:CH4+2O2 $\stackrel{点燃}{→}$CO2+2H2O.一定量的该气体燃烧过程的能量变化如图所示,从图中可以读出E1>E2(填写“>”或者“<”),该反应放热(填写“放出”或者“吸收”)能量.该物质与Cl2反应方程式为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl(只写出第一步反应),该反应类型为取代反应.
;空间构型:正四面体.这种化合物中碳元素的质量分数为75%.该物质在氧气中充分燃烧的反应方程式:CH4+2O2 $\stackrel{点燃}{→}$CO2+2H2O.一定量的该气体燃烧过程的能量变化如图所示,从图中可以读出E1>E2(填写“>”或者“<”),该反应放热(填写“放出”或者“吸收”)能量.该物质与Cl2反应方程式为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl(只写出第一步反应),该反应类型为取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 异戊二烯( )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 | |
| B. | 2-氯丙烷( )与NaOH乙醇溶液共热发生消去HCl分子的反应 )与NaOH乙醇溶液共热发生消去HCl分子的反应 | |
| C. | 丙烷与氯气在光照的条件下发生取代反应生成一氯代物的反应 | |
| D. | 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ①中物质 | ②中物质 | 实验预测 | |
| A | 浓氨水 | 酚酞试液 | ②中溶液变为红色 |
| B | 浓硝酸 | 淀粉KI溶液 | ②中溶液变为蓝色 |
| C | 浓盐酸 | 浓氨水 | 大烧杯中有白烟 |
| D | 饱和的亚硫酸溶液 | 稀溴水 | ②中无明显变化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:(查阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关.)
为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:(查阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关.)| 操作 | 现象和结论 |
| ①取一定量2mol/LNaCl溶液,调节溶液pH为4.91;再以相同装置进行电解. ②电解相同时间后,若电极b表面无气泡,取少量阳极附近的溶液, 滴入淀粉KI溶液. | 若溶液不变蓝,证明猜想①不成立 若溶液变蓝,证明猜想①可能成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 含量/% 阶段 | Y2O3 | ZnO | Al2O3 | PbO2 | MgO |
| 预处理前 | 24.28 | 41.82 | 7.81 | 1.67 | 0.19 |
| 预处理后 | 68.51 | 5.42 | 4.33 | 5.43 | 0.50 |
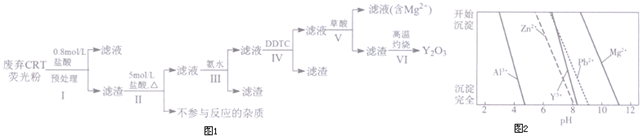
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置 |  |  |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com