
一定条件下,分别对反应C(s)+CO2(g)2CO(g)(正向吸热)进行如下操作(只改变该条件):①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应速率显著变大的是( )
A.①②③④ B.①③④
C.①② D.①③
科目:高中化学 来源: 题型:
锌锰干电池由于其贮存和使用寿命较短,大都为一次性电池,用完之后被当作垃圾扔掉。这不仅浪费了宝贵的金属资源,而且还会产生严重的环境污染。下表是各类电池的综合成分分析结果:
| 元素 | 锌 | 锰 | 铁 | 铜 | 碳 | 其它 |
| 质量百分含量 | 13~27 | 14~28 | 23~26 | 0.5~0.7 | 5~6 | 13 |
通过简单的机械处理,将电池中各组分进行最大在限度的分离,从而使整个处理过程得到简化。再分别对锌皮和锰粉(MnO2)进行湿法处理,通过预处理、浸取、净化等工序制出产品。工艺流程如下图:
查阅资料知各离子沉淀完全的pH为
| 离子 | Fe3+ | Fe2+ | Cu2+ | Mn2+ |
| pH | 3.2 | 9.0 | 6.7 | 10.1 |
已知:锌元素与铝元素相似,具有两性。
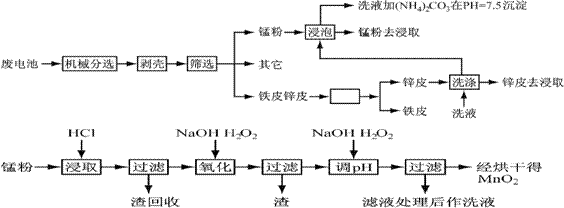
1、市售锌锰干电池为碱性电池,电解质溶液为KOH,则其正极反应为 ;
电极总反应方程为 ;
2、在预处理中,分离铁皮和锌皮的方法是 ,洗液加(NH4)2CO3在pH=7.5沉淀出一种碱式盐,该物质的化学式为 。
3、二氧化锰生产中,写出加入30%盐酸溶解时的离子方程式 ;盐酸溶解后回收的渣是 ;
4、已知第二次加H2O2后调节pH≈9的目的为将Mn2+转化为MnO2,则第一次加H2O2后调节pH≈5,目的是 ;
5、实验室中用高锰酸钾溶液检验Mn2+时,产生黑色沉淀,该反应的离子方程式为
;
6、硫酸锰在高温条件下可以得到三种氧化物,该热分解的方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用甲苯生产对羟基苯甲酸乙酯( ),其过程如下:
),其过程如下:

据合成路线填写下列空白:
(1)有机物A的结构简式:____________________,B的结构简式:____________________。
(2)反应④属于____________反应,反应⑤属于______________反应。
(3)③和⑥的目的是______________________________________________。
(4)写出反应⑥的化学方程式:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
优良的有机溶剂对孟烷和耐热型特种高分子功能材料PMnMA的合成路线如下:

已知:①芳香族化合物苯环上的氢原子可被卤代烷中的烷基取代。如:
 +RX
+RX
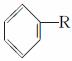 +HX(R是烃基,X为卤原子)
+HX(R是烃基,X为卤原子)
②0.01 mol C质量为1.08 g,能与饱和溴水完全反应生成3.45 g白色沉淀,E不能使Br2的CCl4溶液褪色。
③G的核磁共振氢谱有3种峰,其峰面积之比为3∶2∶1,G与NaCO3溶液反应放出气体。
根据以上信息回答以下问题:
(1) 化合物A的名称为________;F的官能团结构简式为________________;C的结构简式为
________________。
(2)下列说法正确的是________(填选项字母)。
a.B可使酸性高锰酸钾溶液褪色
b.C不存在芳香族醛类同分异构体
c.D的酸性比E弱
d.F不能使溴水褪色
(3)①E与G反应生成H的化学方程式为______________________________,
其反应类型为________;
②PMnMA的结构简式为________,由H生成该有机物的反应类型为________。
(4)G的能水解的链状同分异构体有________种,其中不能发生银镜反应的有机物结构简式为
____________________(写出一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对玻璃钢的叙述正确的是( )
A.玻璃钢是由普通玻璃加强热然后骤冷而得到的,所以其成分与普通玻璃相同
B.玻璃钢是以玻璃为基体,钢纤维做增强体的复合材料
C.玻璃钢的基体是合成树脂,增强体是玻璃纤维
D.玻璃钢的强度和机械加工性能比合金钢稍差,但耐腐蚀性和绝缘性比合金钢好
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中发生反应:2X(g)+Y(g)aZ(g) ΔH=Q kJ·mol-1,开始按体积比2:1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图象,下列有关说法正确的是( )

A.图甲,p1>p2,a<3
B.图甲,T1<T2,Q>0
C.图乙,t1时表示恒温、恒压条件下,向平衡体系中充入一定量的Z气体
D.图乙,如果a=3,t2时表示向体系中加入了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知:2SO3(g)2SO2(g)+O2(g),在起始时体积相同的容器A和B中同时分别充入2 mol SO3(两容器装有催化剂)。在反应过程中,A保持温度和容积不变;B保持温度和压强不变。回答下列问题:
①反应达平衡所需时间:A________B(填“>”、“=”或“<”,下同);达平衡时SO3的转化率:A________B。
②若平衡后,向A、B中分别充入稀有气体,________(填“A”或“B”)容器中的平衡将向________(填“正反应”或“逆反应”)方向移动。
(2)一定条件下,有反应:X(g)+2Y(g)2Z(g) ΔH=Q kJ/mol,该反应的平衡常数表达式为________。
①在体积为2 L的密闭容器C中,充入1 mol X和2 mol Y进行反应,2 min后反应达到平衡,此时平衡混合物中X为0.8 mol,则以Y浓度变化表示的反应速率为________mol/(L·min),X的转化率为________。
②在恒温恒压条件下,向密闭容器D中充入0.5 mol X和1 mol Y,达到平衡后Z的物质的量分数为a,如果再向容器中充入0.5 mol Z,重新平衡后Z的物质的量分数为b,则a________b(填“>”、“<”或“=”)。

③如图所示曲线Ⅰ、Ⅱ是该反应在只有一个反应条件不同时Z的体积分数与时间的关系图,下列有关曲线Ⅰ、Ⅱ的叙述,正确的是________(填字母)。
A.Ⅰ没有用催化剂,Ⅱ用了催化剂
B.Ⅱ的反应温度比Ⅰ高且Q<0
C.Ⅱ的压强比Ⅰ大
查看答案和解析>>
科目:高中化学 来源: 题型:
海水中富含镁,可经过加碱沉淀、过滤、酸溶、结晶及脱水等步骤得到无水氯化镁,最后电解得到金属镁。
(1)加碱沉淀镁离子时,生成的Mg(OH)2在分散系中处于沉淀溶解平衡,其溶度积常数表达式Ksp= 。
(2)MgCl2溶液显酸性,其水解的离子方程式为 。
(3)除去MgCl2酸性溶液中少量的FeCl3,可加入的试剂有 。
a.MgO b.NaOH c.Mg(OH)2 d.MgSO4
(4)若在空气中加热MgCl2·6H2O,可水解生成Mg(OH)Cl,写出相关的化学方程式 。所以,为了抑制MgCl2·6H2O在加热时水解,可在干燥的
气流中加热,可得到无水氯化镁。
(5)用惰性电极电解熔融的MgCl2,阳极的电极反应式为: ;
如果电解MgCl2溶液,阴极的电极反应式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com