
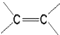 )中的π-键不能自由旋转,因此
)中的π-键不能自由旋转,因此 和
和 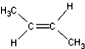 是两种不同的化合物,互为顺反异构体.则分子式为C3H2Cl4的化合物的链状异构体有( )
是两种不同的化合物,互为顺反异构体.则分子式为C3H2Cl4的化合物的链状异构体有( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 长期饮用纯净水,有可能引起一些微量元素缺乏症 | |
| B. | 明矾既能沉降水中的悬浮物,又能杀菌消毒 | |
| C. | 合成洗涤剂和纯碱溶液都可洗去油污,二者去污原理相同 | |
| D. | 纤维素被食用进入人体内,在酶的作用下最终水解为葡萄糖为人体提供能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用金属钠可鉴别乙醇和乙醚 | |
| B. | 用新制的银氨溶液可鉴别甲酸乙酯和丙醛 | |
| C. | 用水可鉴别苯和溴苯 | |
| D. | 用酸性高锰酸钾溶液可鉴别己烷和3-己烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
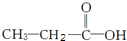 和
和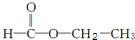 两种,为对其结构进行物理方法鉴定,常用红外光谱和核磁共振氢谱法.
两种,为对其结构进行物理方法鉴定,常用红外光谱和核磁共振氢谱法.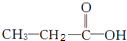 ,则红外光谱中应该有5个吸收峰;核磁共振氢谱中应有4个吸收峰.
,则红外光谱中应该有5个吸收峰;核磁共振氢谱中应有4个吸收峰. ,则红外光谱中应该有4个吸收峰;核磁共振氢谱中应有3个吸收峰.
,则红外光谱中应该有4个吸收峰;核磁共振氢谱中应有3个吸收峰.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图是A分子的球棍模型和B分子的比例模型,回答下列问
如图是A分子的球棍模型和B分子的比例模型,回答下列问查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
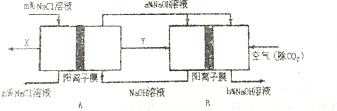
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com