
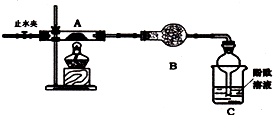

分析 (1)①装置B的形状和作用可知为干燥管,盛放固体干燥剂,检验氨气利用装置C中的酚酞溶液,装置B是除去生成的硫的氧化物;
②装置C中可观察到的现象是变红色,证明分解产物中生成了氨气;
(2)①乙组选用甲组实验中的装置A和图2所示的装置进行实验验证硫酸亚铁铵分解的产物中还有SO2和SO3,分解产物通过装置D防止倒吸和冷凝,通过装置H中的足量元素和氯化钡溶液检验是否生成气体中含三氧化硫,通过装置E检验三氧化硫是否除净,通过装置G过氧化氢氧化二氧化硫为硫酸,结合钡离子生成白色沉淀,最后剩余二氧化硫气体需要尾气吸收,通入一段时间N2后,关闭止水夹再点燃酒精灯,目的是干净装置中的氧气避免对二氧化硫检验的干扰;
②装置H中有白色沉淀,说明生成了不溶于水、不溶于酸的沉淀为硫酸钡沉淀,G中过氧化氢氧化二氧化硫为了谁,和氯化钡反应生成硫酸钡不是沉淀;
(3)①利用二价铁离子具有还原性设计实验检验;
②精确称量充分加热前后固体的质量,经过计算判断.
解答 解:(1)①装置B的形状和作用可知为球形干燥管,盛放固体干燥剂,硫酸亚铁铵[(NH4)2Fe(SO4)2•6H2O]分解可能的产物为氨气、硫的氧化物和水,检验氨气利用装置C中的酚酞溶液,所以装置B是除去生成的硫的氧化物为碱石灰,
故答案为:球形干燥管;碱石灰;
②装置C中可观察到的现象是变红色,氨气溶于水生成一水合氨是弱碱,溶液中电离显碱性,遇到酚酞变红色,证明分解产物中生成了氨气,
故答案为:溶液由无色变红色;NH3;
(2)①乙组选用甲组实验中的装置A和图2所示的装置进行实验验证硫酸亚铁铵分解的产物中还有SO2和SO3,分解产物通过装置D防止倒吸和冷凝,通过装置H中的足量元素和氯化钡溶液检验是否生成气体中含三氧化硫,通过装置E检验三氧化硫是否除净,通过装置G过氧化氢氧化二氧化硫为硫酸,结合钡离子生成白色沉淀,最后剩余二氧化硫气体需要尾气吸收,据上述分析可知装置连接顺序为ADHEGF,取适量硫酸亚铁铵固体于A中,通入一段时间N2后,关闭止水夹再点燃酒精灯,目的是干净装置中的氧气避免对二氧化硫检验的干扰,
故答案为:DHEGF;排尽装置中的空气(或O2),防止对SO2的验证产生干扰;
②装置H中有白色沉淀,说明生成了不溶于水、不溶于酸的沉淀为硫酸钡沉淀,原气体中生成了SO3,G中过氧化氢氧化二氧化硫生成硫酸,硫酸和氯化钡反应生成硫酸钡白色沉淀,反应的离子方程式为:SO2+2H2O2+Ba2+=BaSO4↓+H2O+2H+,能证明分解产物中有S02韵实验现象是E中无明显现象,G中出现白色沉淀,
故答案为:SO3 ;E中无明显现象,G中出现白色沉淀;
(3)①利用二价铁离子具有还原性设计实验检验,实验设计为:取少量固体于试管中,加稀硫酸溶解,再滴入KMnO4溶液,KMnO4溶液不褪色,证明此固体产物不含二价铁,
故答案为:取少量固体于试管中,加稀硫酸溶解,再滴入KMnO4溶液,KMnO4溶液不褪色;
②依据反应前后质量变化,精确称量充分加热前后固体的质量,经过计算即可判定残留固体的成分是否全部为氧化铁,
故答案为:精确称量充分加热前后固体的质量,经过计算即可判定残留固体的成分是否全部为氧化铁.
点评 本题考查了物质性质、物质分解产物的实验验证,注意检验实验设计应避免干扰验,试剂选择和反应现象的理解应用是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随着电子层数增多,碱金属的原子半径逐渐增大 | |
| B. | 碱金属具有强还原性,它们的离子具有强氧化性 | |
| C. | 碱金属单质的熔沸点随着核电荷数的增大而降低 | |
| D. | 碱金属元素在自然界中都是以化合态存在的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol/L | B. | 1.8 mol/L | C. | 1.9 mol/L | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每消耗1molCH4可以向外电路提供4mole- | |
| B. | 电池放电后,溶液PH不断升高 | |
| C. | 负极上O2得到电子,电极反应式为:O2+2H2O+4e-═4OH- | |
| D. | 负极上CH4失去电子,电极反应式:CH4+10OH--8e-═CO32-+7H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com