
 如图为某市售盐酸试剂瓶标签上的部分数据.问:
如图为某市售盐酸试剂瓶标签上的部分数据.问:| 1000ρω |
| M |
| 1000×1.18×36.5% |
| 36.5 |
| 0.1mol |
| 1L |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、390.7kj/mol |
| B、-679.3kj/mol |
| C、-787kj/mol |
| D、+180.9kj/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
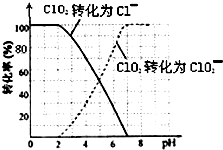 二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.比Cl2更好.
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.比Cl2更好.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu、Fe3+ |
| B、Fe2+、Fe3+ |
| C、Cu、Cu2+ |
| D、Cu、Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com