
 汽车尾气作为空气污染的主要来源之一,含有大量的有害物质,包括CO、
汽车尾气作为空气污染的主要来源之一,含有大量的有害物质,包括CO、| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 207 | 0.20 | 0.090 | 0.090 |
分析 (1)已知①CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ•mol-1,
②CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1,
利用盖斯定律将$\frac{①+②}{2}$可得CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g),据此分析;
(2)依据亚硝酸根离子水解平衡常数表达式变式计算分析;
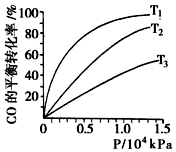
(3)正反应放热,则升高温度CO的转化率降低;
(4)对比I、Ⅱ可知,升高温度CH3OCH3(g)的物质的量减小,说明平衡逆向移动,而升高温度平衡向吸热反应移动;
根据I中数据计算平衡常数,计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行.
解答 解:(1)已知①CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ•mol-1,
②CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1,
利用盖斯定律将$\frac{①+②}{2}$可得CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g),△H=-$\frac{574+1160}{2}$kJ•mol-1=867kJ•mol-1,
故答案为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1;
(2)NO2-+H2O?HNO2+OH-,Kh=$\frac{c(HN{O}_{2})•c(O{H}^{-})}{c(N{{O}_{2}}^{-})}$=$\frac{c(HN{O}_{2})•c(O{H}^{-})}{c(N{{O}_{2}}^{-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{{K}_{w}}{{K}_{a}}$,则Kw=Kh×Ka=8.0×10-10mol•L-1×9.7×10-4mol•L-1=7.76×10-13,>常温下Kw=10-14,温度高于常温,>25°C,
故答案为:Ka×K;>;
(3)根据该反应为放热反应,温度越高CO的转化率越小,图中T1、T2、T3的高低顺序T1<T2<T3,
故答案为:T1<T2<T3,该反应为放热,温度越高,反应物的转化率越低;
(4)对比I、Ⅱ可知,升高温度CH3OCH3(g)的物质的量减小,说明平衡逆向移动,而升高温度平衡向吸热反应移动,则正反应为放热反应,容器Ⅰ中平衡时c(CH3OCH3)=c(H2O)=$\frac{0.08mol}{1L}$=0.080mol/L,c(CH3OH)=$\frac{0.2mol-0.08mol×2}{1L}$=0.04mol/L,容器Ⅰ中化学平衡常数K1=$\frac{c({H}_{2}O)×c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{H}_{3}OH)}$=$\frac{0.08×0.08}{0.0{4}^{2}}$=4,此时浓度商Qc=$\frac{c({H}_{2}O)×c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{H}_{3}OH)}$=$\frac{0.15×0.1}{0.1{5}^{2}}$=0.67<K=4,反应向正反应进行.
故答案为:放热,正.
点评 本题目综合考查盖斯定律的应用、化学反应平衡常数的计算和应用、图象分析判断等方面的知识,侧重于影响平衡移动及平衡常数的因素的考查,注意知识的归纳和整理是关键,题目难度中等.注意料电池反应的特点.


科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol•L-1的Na2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | pH=11的氨水与pH=3的硫酸各1L混合后,c(NH4+)>2c(SO42-) | |
| C. | pH=11的氨水与pH=11的醋酸钠溶液,由水电离出的c(H+)相等 | |
| D. | pH相同的①NaHCO3溶液②CH3COONa溶液中的c(Na+):①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用冰水混合物冷却SO3气体;加热I2 | |
| B. | 木炭吸附NO2气体;将Cl2通入品红溶液中 | |
| C. | 打开盛有NO的集气瓶;冷却NO2气体 | |
| D. | 向品红溶液中通入SO2,向FeCl3溶液滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
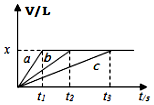 将等物质的量钠、镁、铝三种金属分别与200mL1mol•L-1的盐酸反应,测得生成的气体的体积V(已折合成标准状况的体积)与时间t的关系如图所示.下列说法正确的是( )
将等物质的量钠、镁、铝三种金属分别与200mL1mol•L-1的盐酸反应,测得生成的气体的体积V(已折合成标准状况的体积)与时间t的关系如图所示.下列说法正确的是( )| A. | x=44.8 | B. | 反应后的镁和铝均有剩余 | ||
| C. | 金属的物质的量可能均为0.1mol | D. | 曲线c表示钠与盐酸的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,2.8 g N2和CO的混合气体所含原子数为0.2 NA | |
| B. | 1 mol Cl2与足量Fe完全反应,转移3NA个电子 | |
| C. | 1 L 0.1 mol•L-1NaHCO3溶液中含有0.1 NA个HCO3- | |
| D. | 常温常压下,22.4L乙烯中C-H键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
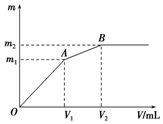 向含0.02mol Al3+的明矾溶液中逐滴加入0.2mol/L的Ba(OH)2溶液时,测得产生沉淀的质量m和逐滴加入Ba(OH)2溶液的体积V的关系如图所示.计算出A、B点分别对应的m、V,填 在下面的横线上.
向含0.02mol Al3+的明矾溶液中逐滴加入0.2mol/L的Ba(OH)2溶液时,测得产生沉淀的质量m和逐滴加入Ba(OH)2溶液的体积V的关系如图所示.计算出A、B点分别对应的m、V,填 在下面的横线上.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 硝酸越稀还原产物中氮元素的化合价越低.某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出.在反应后的溶液中逐滴加入4mol•L-1 NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图.下列说法不正确的是( )
硝酸越稀还原产物中氮元素的化合价越低.某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出.在反应后的溶液中逐滴加入4mol•L-1 NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图.下列说法不正确的是( )| A. | D点溶液中存在:c(NH4+)+c(Na+)+c(H+)=c(OH-)+c(NO3-) | |
| B. | EF段发生化学反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O | |
| C. | 原溶液中n(NH4+)=0.012mol | |
| D. | 溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com