
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 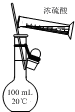 用如图装置配制100 mL 0.1 mol/L的硫酸 | |
| B. |  用如图装置提取碘水中碘 | |
| C. |  用如图装置制取少量乙烯气体 | |
| D. | 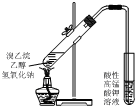 用如图装置验证溴乙烷发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
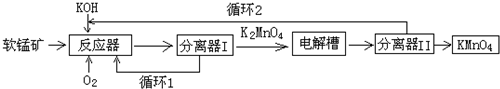
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑦ | B. | ①②⑤⑥ | C. | ③⑤⑥⑦ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 白磷的燃烧热为E2-E1 | |
| B. | 白磷分子中磷原子的杂化方式为sp3 | |
| C. | 1molP4O10中σ键的数目为16NA | |
| D. | 假设P-P、P-O、O=O的键能分别为a、b、c,则P=O的健能为(6a+5c-12b)/4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
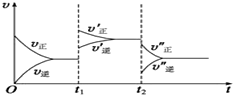 对于①N2(g)+3H2(g)??2NH3(g)△H<0 ②2NH3(g)?N2(g)+3H2(g)△H>0其中v-t图象为:
对于①N2(g)+3H2(g)??2NH3(g)△H<0 ②2NH3(g)?N2(g)+3H2(g)△H>0其中v-t图象为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和滴定盛待测液的锥形瓶中有少量水对滴定结果无影响,锥形瓶不能用待测液润洗 | |
| B. | 酸式和碱式滴定管用蒸馏水洗净后还需用标准液或待测液润洗 | |
| C. | 滴定时左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管的液面 | |
| D. | 称量氯化钠固体,氯化钠放在称量纸上,置于托盘天平的左盘,砝码放在天平的右盘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.030 | 0.039 | 0.040 | 0.040 |
| A. | 保持其他条件不变,升高温度,平衡时c(Cl2)=0.022mol•L-1,则反应的△H<0 | |
| B. | 反应在前2s的平均速率v(CO)=0.015mol•L-1•S-1 | |
| C. | 保持其他条件不变,起始向容器中充入0.12molCOCl2和0.060molCl2、0.060 molCO,反应达到平衡前的速率:v正<v逆 | |
| D. | 保持其他条件不变,起始向容器中充入0.10molCl2和0.08molCO,达到平衡时,Cl2的转化小于60% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学分析Zn与稀H2SO4的反应.
某同学分析Zn与稀H2SO4的反应.| 1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
| 1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com