
【题目】铁和锌的混合物共31.6克,与足量稀硫酸反应,产生标准状况下氢气11.2 升,
问:①产生标准状况下氢气的物质的量是多少?__________
②混合物中锌的物质的量是多少___________?铁的质量是多少?___________
③参与反应的硫酸物质的量是多少?_____________
【答案】0.5 mol0.4 mol5.6 g0.5mol
【解析】
①标准状况下11.2LH2的物质的量为![]() =0.5 mol,答:H2的物质的量是0.5mol;
=0.5 mol,答:H2的物质的量是0.5mol;
②令铁和锌的物质的量分别为amol、bmol,则:
Fe~~~~H2
amol amol
Zn~~~~H2
bmol bmol
所以a+b=0.5mol,56g/mol×a+65 g/mol×b=31.6g,解得:a=0.4mol,b=0.1mol,故混合物铁的质量为0.1mol×56g/mol=5.6g,答:混合物中锌的物质的量是0.4mol,铁的质量为5.6g;
③参与反应的硫酸物质的量与生成的氢气的物质的量相等,为0.5mol,答:参与反应的硫酸物质的量为0.5mol。


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是一种应用广泛的化工产品,可用于合成抗生素头孢菌素药物的中间体,汽车安全气囊等。回答下列问题:
Ⅰ.实验室制备NaN3
水合肼(N2H4·H2O) 与亚硝酸甲酯(CH3ONO)在氢氧化钠存在下制备NaN3,其反应装置如图所示:
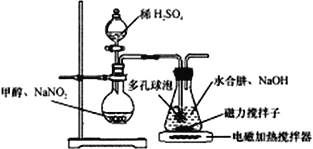
已知:2CH3OH+2NaNO2+H2SO4→2CH3ONO+ Na2SO4+2H2O; NaN3无色无味,微溶于醇、溶于水
(1)N2H4的电子式为_______________;NaN3晶体中阴离子与阳离子个数比为______________。
(2)装置中多孔球泡的作用是___________________。
(3)锥形瓶中水合肼与亚硝酸甲酯在30℃时可以反应生成叠氮酸钠、甲醇等物质,写出该反应的化学方程式_______________________________。
Ⅱ.回收甲醇
将制备反应后所得混合溶液加入烧瓶中,按照下图所示装置进行减压蒸馏。
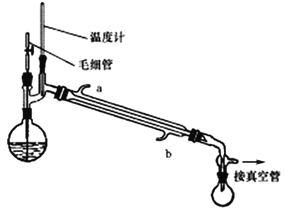
已知:
物质 | CH3OH | N2H4 | NaN3 |
沸点/℃ | 64.7 | 113.5 | 300 |
NaN3在40℃时分解
(4)实验时冷凝管中冷却水要“b进a出”原因是______________________。
(5)甲醇回收时需用减压蒸馏的原因是________________________。
(6)下列有关毛细管的作用说法正确的是_______________。
A.平衡圆底烧瓶内外压 B.作为气化中心,使蒸馏平稳
C.避免液体过热而暴沸 D.冷凝回流作用
Ⅲ.产品提取及纯度测定
将蒸馏后所得母液降温结晶,过滤得NaN3湿品;再用去离子水重结晶得NaN3产品并用碘量法测定产品纯度。取产品6.50g加入足量去离子水中溶解,并加入适量稀硫酸酸化;向混合液中加入20.00mL 1.00mol·L-lKMnO4溶液,溶液呈紫红色;再加入足量KI溶液消耗过量的KMnO4溶液;其后用0.100mol·L-lNa2S2O3标准溶液滴定所产生的I2,消耗Na2S2O3溶液30.00mL。
(7)实验所得产品的纯度为______________________。
已知:①产品中杂质不参与反应;
②测定过程中发生的反应:
10NaN3+2KMnO4+8H2SO4==2MnSO4+K2SO4+5Na2SO4+8H2O+15N2↑;
10KI+2KMnO4+8H2SO4==2MnSO4+6K2SO4+8H2O+5I2;
I2+2Na2S2O3==2NaI +Na2S4O6。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2溶液中,选择A、B、C 3种试剂,按图中的实验步骤进行操作:

(1)3种试剂的化学式:A______,B______,C______。
(2)加过量A的原因是___________________________________________________________,有关反应的化学方程式为________________________________________________________________。
(3)加过量B的原因是______________________________________________________,有关反应的化学方程式为_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中不正确的是()
A. 若由CO2和O2组成的混合物中共有NA个分子,则其中的氧原子数为2NA
B. 压强为1.01×105Pa时,48g O2和O3的混合物中含有的原子数为3NA
C. 常温下,8 g NH4NO3所含的氮原子数为0.1NA
D. 1.7 g H2O2中含有的电子数为0.9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法不正确的是
A. 1mol—CH3中含有的质子数为10NA
B. H2O2+Cl2=2HC1+O2反应中,每生成32g O2转移2NA个电子
C. 3.6gCO和 CO2的混合气体含中子数为1.8NA
D. 6.2g 白磷含有0.3NAP-P键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1 mol/L、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100 mL,Va、Vb与混合液的pH的关系如图所示。下列说法正确的是
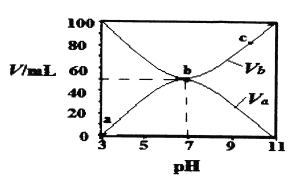
A. Ka(HA)=10-6mol·L-l
B. b点时,c(B+)=c(A-)=c(H+)=c(OH-)
C. b→c过程中,![]() 随温度升高而增大
随温度升高而增大
D. a→c过程中水的电离程度始终增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是硫酸试剂瓶标签上的内容:

(1)该硫酸的物质的量浓度是________mol/L
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要 240mL4.6mol/L 的稀硫酸,用该硫酸配制,选取的容量瓶规格为 250mL,则需要量取________mL 的该硫酸.
(3)用上述硫酸配制所需的稀硫酸时,实验仪器有:
①50mL 量筒 ②100mL 量筒 ③托盘天平 ④玻璃棒 ⑤250mL 容量瓶 ⑥胶头滴管 ⑦烧杯 ⑧锥形瓶
实验时选用仪器的先后顺序为 → →④→ → ._____________
(4)下列情况导致所配硫酸溶液物质的量浓度偏高的有________.
①未经冷却趁热将溶液注入容量瓶中
②容量瓶用 4mol/L 硫酸润洗
③定容时仰视观察液面
④颠倒摇匀后发现液面低于刻度线再加水
⑤用量筒量取浓硫酸后,用蒸馏水洗涤量筒,洗液也转移至容量瓶中.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雷雨天闪电时空气中有臭氧(O3)生成,下列说法不正确的是
A.O2和O3互为同素异形体
B.同温同压下,等体积的O2和O3具有相同的原子数
C.O2和O3的相互转化是化学变化
D.氧气比臭氧稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某次实验需用80mL、3mol/L 的稀H2SO4溶液,某同学用98%的浓H2SO4(ρ=1.84g/cm3)进行配制,请回答下列问题:
(1)98%的浓H2SO4(ρ=1.84g/cm3)的物质的量浓度为________。
(2)配制80mL、3mol/L 的稀H2SO4溶液,则需取98%的浓H2SO4________mL,量取浓硫酸所用的量筒的规格是________(从下列中选用)A.10mL B.25mL C.50mL D.100mL
(3)将下列步骤中的空格补充填写完整
①用量筒量取所需的浓硫酸
②将烧杯中的溶液__________________________________________________
③将浓硫酸缓缓注入盛有适量蒸馏水的烧杯中,边加边搅拌
④将溶液冷却,恢复至室温
⑤向容量瓶中加入蒸馏水_____________________________________________
⑥盖好瓶塞,反复上下颠倒,摇匀
⑦洗涤烧杯2~3次,洗涤液也注入容量瓶中.轻轻摇动容量瓶,使溶液混合均匀.
(4)实验中上述步骤的正确排序为________(填序号)
(5)下列各种情况使所配制溶液浓度偏高的__________________
A.未经冷却趁热将溶液注入容量瓶中
B将量筒中残留的浓硫酸洗涤后.转移入容量瓶中
C.定容时仰视液面读数
D量取浓硫酸时俯视读数
(6)取用任意体积的所配3mol/L硫酸溶液时,下列物理量中不随所取体积的多少而变化的是_______(填字母)
A、溶液中H2SO4的物质的量 B、溶液的浓度 C、溶液中SO42的数目D、溶液的密度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com