
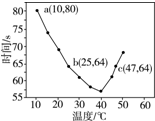
| A. | 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 | |
| B. | 图中b、c两点对应的NaHSO3的反应速率相等 | |
| C. | 图中a点对应的NaHSO3的反应速率为5.0×10-5 mol•(L•s)-1 | |
| D. | 温度高于40℃时,淀粉不宜用作该实验的指示剂 |
分析 A.由图可知,40℃之前,温度高反应速率加快,40℃之后温度高,变色时间越长;
B.b、c点对应的温度不同;
C.a点时间为80s,浓度变化量为$\frac{0.02mol/L×0.01L}{0.05L}$=0.004mol/L;
D.结合55℃时,没有出现蓝色分析.
解答 解:A.从图象中可以看出,40℃以前,温度越高,反应速度越快,40℃后温度越高,变色时间越长,反应越慢,而55℃,未变蓝,淀粉发生了水解,故A正确;
B.由图中b、c反应时间相同、温度不同可知,温度高反应速率快,故反应速率不同,故B错误;
C.a点时间为80s,浓度变化量为$\frac{0.02mol/L×0.01L}{0.05L}$=0.004mol/L,a点对应的NaHSO3反应速率为$\frac{0.004mol/L}{80s}$=5.0×10-5mol•L-1•s-1,故C正确;
D.55℃时,没有出现蓝色,淀粉发生水解反应,故淀粉已不能作为该反应的指示剂,故D正确;
故选B.
点评 本题考查化学反应速率的影响因素,侧重图象分析及温度对反应的影响,注意不同温度下均可被过量KIO3氧化,注重分析能力和解决问题能力的考查,题目难度较大.


 一课一练课时达标系列答案
一课一练课时达标系列答案 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:选择题
已知反应A(g)+3B(g)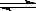 2C(g)+D(s),1molA和3molB在2L密闭容器中进行上述反应,若2min后,测得C的浓度为0.2mol/L,则下列说法正确的是( )
2C(g)+D(s),1molA和3molB在2L密闭容器中进行上述反应,若2min后,测得C的浓度为0.2mol/L,则下列说法正确的是( )
A.v(D)=0.05mol/(L•min) B.v(B)=0.15mol/(L•min)
C. 3v(B)=2v(C) D.A的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酸性高锰酸钾溶液鉴别乙烷与乙烯 | |
| B. | 向蔗糖溶液中加入稀硫酸,加热,冷却后加入新制Cu(OH)2检验水解产物 | |
| C. | 用饱和Na2CO3溶液鉴别乙酸、乙醇、硝基苯 | |
| D. | 利用燃烧的方法鉴别羊毛和棉花 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、苯、乙酸分子中的所有原子都在同一平面上 | |
| B. | 蛋白质、淀粉、纤维素和油脂都属于高分子化合物,一定条件下都能水解 | |
| C. | 甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同 | |
| D. | 甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用酸性KMnO4溶液除去乙烷中的乙烯 | |
| B. | 乙烷和乙烯都能使酸性KMnO4溶液褪色 | |
| C. | 淀粉、油脂、蔗糖在一定条件下都能发生水解 | |
| D. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
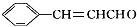 ,在催化剂存在条件下1mol D与2mol H2反应可以生成乙;丙中含有两个-CH3
,在催化剂存在条件下1mol D与2mol H2反应可以生成乙;丙中含有两个-CH3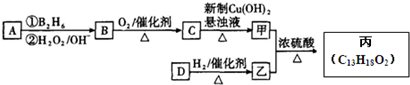
 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com