
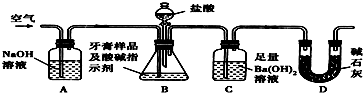
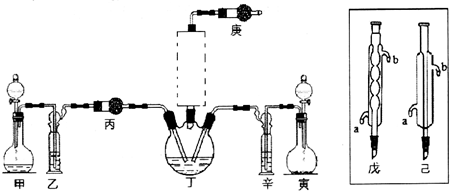
分析 (1)利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,依据碳元素守恒以确定碳酸钙的质量分数,装置D防止空气中二氧化碳进入装置C;
(2)该牙膏摩擦剂由碳酸钙、氢氧化铝组成,滴入盐酸,碳酸钙和盐酸反应生成氯化钙、二氧化碳和水;
(3)a、实验结束时继续通入空气一会儿,排净装置内的CO2气体,防止影响碳酸钡质量的测定;
b、滴加盐酸过快CO2,CO2不能完全被吸收,排出装置C;
c、在AB之间增添盛有浓硫酸的洗气装置,吸收水分,不影响CO2;
d、在BC之间增添盛有饱和碳酸氢钠溶液的洗气装置Ba(OH)2,可以吸收CO2中的HCl,而不影响CO2;
(4)BaCO3质量为3.94g n(BaCO3)=0.0200mol,则n(CaCO3)=0.0200mol,质量为2.00g;
(5)B中的水蒸气、氯化氢气体等进入装置C中.
解答 解:(1)利用如图所示装置测定C中生成的BaCO3沉淀质量,依据碳元素守恒以确定碳酸钙的质量分数,装置D防止空气中二氧化碳进入装置C,装置D的作用是防止空气中的二氧化碳进入装置C干扰碳酸钙的定量测定,
故答案为:防止空气中的二氧化碳进入装置C干扰碳酸钙的定量测定;
(2)该牙膏摩擦剂由碳酸钙、氢氧化铝组成,滴入盐酸,碳酸钙和盐酸反应生成氯化钙、二氧化碳和水,反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O,
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;
(3)a、实验结束时继续通入空气一会儿,排净装置内的CO2气体,防止影响碳酸钡质量的测定,可以提高测定准确度,故a不符合;
b、滴加盐酸过快CO2,CO2来不及被吸收,就排出装置C,滴加盐酸不宜过快,使二氧化碳吸收完全,可以提高测定准确度,故b不符合;
c、在AB之间增添盛有浓硫酸的洗气装置,吸收水分,不影响CO2,不能提高提高测定准确度,故c符合;
d、在BC之间增添盛有饱和碳酸氢钠溶液的洗气装置Ba(OH)2,可以吸收CO2中的HCl,影响CO2,不能提高测定准确度,故d符合;
故答案为:cd;
(4)BaCO3质量为3.94g,则n(BaCO3)=$\frac{3.94g}{197g/mol}$=0.02mol,则n(CaCO3)=0.02mol,质量为0.02mol×100g/mol=2g,所以样品中碳酸钙的质量分数为$\frac{2g}{8g}$×100%=25%,
故答案为:25%;
(7)B中的水蒸气、氯化氢气体等进入装置C中,导致测定二氧化碳的质量偏大,测定的碳酸钙的质量偏大,碳酸钙的质量分数偏高,
故答案为:B中的水蒸气、氯化氢气体等进入装置C中.
点评 本题考查较为综合,以物质的制备实验为载体,综合考查实验的设计、物质的分离、提纯等知识,对实验原理与操作步骤的理解及评价、常用化学用语、化学计算、物质组成的测定等,注意根据物质的性质设计实验方案,需要学生具有扎实的基础知识与分析问题、解决问题的能力,理解实验原理是解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
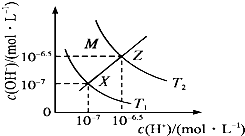
| A. | 由X→Z,c(OH-)增大,所以可以通过加碱来实现 | |
| B. | M区域内任意点均有c(H+)<c(OH-) | |
| C. | T1与T2两条曲线之间的任意点均有c(H+)×c(OH-)=10-14 | |
| D. | XZ线表示c(H+)=c(OH-),溶液显中性,所以XZ线上任意点均有pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ、如果配制3mol/L的NaOH溶液500mL,需称量NaOH固体60.0g.
Ⅰ、如果配制3mol/L的NaOH溶液500mL,需称量NaOH固体60.0g.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成原电池的电极是两种不同的金属 | |
| B. | 原电池是将化学能转化为电能的装置 | |
| C. | 原电池负极发生的电极反应是还原反应 | |
| D. | 原电池的正极是还原剂,总是溶液中的阳离子在此被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入BaCl2溶液中至饱和,无沉淀产生,再通入过量NH3,产生沉淀 | |
| B. | 二氧化硫可广泛用于食品的增白 | |
| C. | 用AlCl3溶液制取Al(OH)3,沉淀剂选用氨水比选用NaOH溶液好 | |
| D. | 纯锌与稀硫酸反应产生氢气的速率较慢,再加入少量CuSO4固体,反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白醋中滴入石蕊溶液呈红色 | |
| B. | 白醋加入豆浆中有沉淀产生 | |
| C. | 蛋壳浸泡在白醋中有气体放出 | |
| D. | 测得白醋溶液中的c(H+)在1×10-2 mol•L-1到1×10-3 mol•L-1之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0 | B. | +2 | C. | +3 | D. | +6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com