
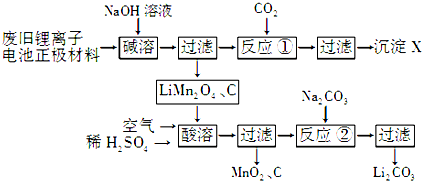
| T/℃ | w(Mn2+)(%) | w(Mn3+)(%) | w(Mn4+)(%) |
| 700 | 5.56 | 44.58 | 49.86 |
| 750 | 2.56 | 44.87 | 52.57 |
| 800 | 5.50 | 44.17 | 50.33 |
| 850 | 6.22 | 44.40 | 49.38 |
分析 废旧锂离子电池正极材料加入碱溶液浸泡,铝溶解在氢氧化钠溶液中(注意LiMn2O4不溶于水)生成偏铝酸钠,即滤液的主要成分,偏铝酸钠与二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,沉淀X为氢氧化铝,LiMn2O4在酸性环境下能被空气中的氧气氧化发生氧化还原反应,得到的滤液中有生成的硫酸锂,可能有过量的硫酸,最后加入碳酸钠之后所得碳酸锂,滤液主要成分为硫酸钠,
(1)偏铝酸钠与二氧化碳反应生成氢氧化铝沉淀;
(2)LiMn2O4在酸性环境下能被空气中的氧气氧化;
(3)酸溶后溶液中含有硫酸,硫酸锂,都与碳酸钠反应;碳酸锂溶解度随温度升高减小;
(4)MnO2和Li2CO3按4:1的物质的量之比配料,高温下可生成LiMn2O4,结合表中数据判断化合价的变化.
解答 解:废旧锂离子电池正极材料加入碱溶液浸泡,铝溶解在氢氧化钠溶液中(注意LiMn2O4不溶于水)生成偏铝酸钠,即滤液的主要成分,偏铝酸钠与二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,沉淀X为氢氧化铝,LiMn2O4在酸性环境下能被空气中的氧气氧化发生氧化还原反应,得到的滤液中有生成的硫酸锂,可能有过量的硫酸,最后加入碳酸钠之后所得碳酸锂,滤液主要成分为硫酸钠,
(1)通入二氧化碳,发生CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,沉淀为Al(OH)3,故答案为:Al(OH)3;
(2)在酸性环境下,LiMn2O4能被空气中的氧气氧化,离子方程式为:4 LiMn2O4+O2+4H+=4Li++8MnO2+2H2O,
故答案为:4LiMn2O4+O2+4H+═4Li++8MnO2+2H2O;
(3)酸溶后溶液中含有硫酸,硫酸锂,都与碳酸钠反应,碳酸锂溶解度随温度升高减小,则工业上洗涤Li2CO3用的是热水而不是冷水,
故答案为:Li2SO4;H2SO4;降低Li2CO3的溶解度,减少溶解;
(4)①MnO2和Li2CO3按4:1的物质的量之比配料,高温下可生成LiMn2O4,反应的离子方程式为8MnO2+2Li2CO3$\frac{\underline{\;高温\;}}{\;}$4LiMn2O4+2CO2↑+O2↑,
故答案为:8MnO2+2Li2CO3$\frac{\underline{\;高温\;}}{\;}$4LiMn2O4+2CO2↑+O2↑;
②由表中数据可知,700~750℃,w(Mn2+)逐渐减小,w(Mn4+)增大,而800~850℃w(Mn2+)逐渐增大,w(Mn4+)减小,可说明锰元素的平均价态的变化趋势是先变大,后变小,
故答案为:先变大,后变小.
点评 本题考查了物质生产流程的分析判断,流程分析,为高频考点,侧重学生的分析、实验能力的考查,把握物质性质的应用是解题关键,答题时注意把握题给信息,难度中等.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
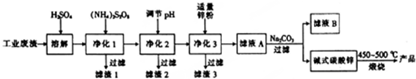
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Al(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 2.7 | 7.5 | 5.4 | 4.0 | 6.4 |
| 完全沉淀时的pH | 3.7 | 9.5 | 6.6 | 5.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
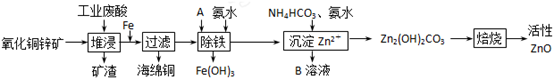
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn、Fe | B. | Fe、Mg | C. | Al、Mg | D. | Zn、Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.36 L | B. | 4.48 L | C. | 5.6 L | D. | 6.72 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
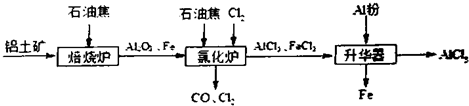
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
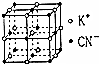 六氰合铁(Ⅲ)酸钾K3[Fe(CN)6]俗称赤血盐,在医药工业、印染工业及钢铁工业均有重要作用,请回答下列问题:
六氰合铁(Ⅲ)酸钾K3[Fe(CN)6]俗称赤血盐,在医药工业、印染工业及钢铁工业均有重要作用,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
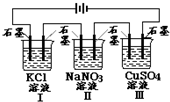 如图装置电解一段时间,当某极析出0.32g Cu时,I、Ⅱ、Ⅲ中溶液pH分别为(溶液足量,体积均为100mL且电解前后溶液体积变化忽略不计)( )
如图装置电解一段时间,当某极析出0.32g Cu时,I、Ⅱ、Ⅲ中溶液pH分别为(溶液足量,体积均为100mL且电解前后溶液体积变化忽略不计)( )| A. | 12、7、2 | B. | 13、7、1 | C. | 1、7、13 | D. | 7、13、1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com