
【题目】下列物质热稳定性最好的是
A. 石灰石 B. 小苏打 C. 纯碱 D. 碳铵
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.铝在空气中耐腐蚀,所以铝是不活泼金属
B.氧化铜和氧化亚铜都是黑色
C.铝在高温下能还原锰、铁、铬等金属氧化物得到金属
D.因为镁和铝在空气中都能形成氧化膜,所以镁铝都不能溶于浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物与人类的生活、生产紧密联系。
(1)已知1g甲烷完全燃烧生成稳定的氧化物时放出Q kJ的热量,写出表示甲烷燃烧热的热化学方程式:
(2)已知:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+130 kJ·mol-1,
2C(s)+O2(g)=2CO(g) ΔH=-220 kJ·mol-1。断开1 mol H—H键、O===O键分别需要吸收436 kJ、496 kJ的热量,则断开1 mol O—H键需要吸收的热量为
A.332 kJ B.118 kJ
C.462 kJ D.360 kJ
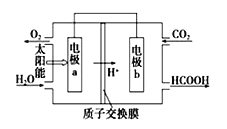
(3)以CO2和H2O为原料制备HCOOH和O2的原电池原理如图.电极a、b表面发生的电极反应式分别为:
a: ,b: .
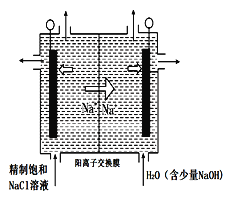
(4)图中用石墨作电极,在一定条件下电解饱和食盐水制取ClO2气体。则阳极产生ClO2的电极反应式为_______________________,用平衡移动原理解释阴极区pH增大的原因:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(共7分)KMnO4是一种用途广泛的氧化剂,可由软锰矿(主要成分为MnO2)通过下列方法制备:①软锰矿与过量KOH、KClO3固体熔融生成K2MnO4;②溶解、过滤后将滤液酸化,使K2MnO4完全转化为MnO2和KMnO4;③滤去MnO2,将滤液浓缩、结晶得到深紫色的KMnO4产品。
(1)溶液酸化时,K2MnO4转变为MnO2和KMnO4的离子方程式是
;
(2)测定KMnO4产品的纯度可用标准Na2S2O3溶液进行滴定。
①配制250 mL0.1 mol/L标准Na2S2O3溶液,需准确称取Na2S2O3固体的质量为 g;
②取上述制得的KMnO4产品0.6000g,酸化后用0.1mol/L标准Na2S2O3溶液进行滴定,滴定至终点消耗Na2S2O3溶液20.00 ml。计算该KMnO4产品的纯度(请给出计算过程)。
![]() (有关离子方程式为:MnO4-+S2O32-+H+ SO42-+Mn2++H2O 未配平)
(有关离子方程式为:MnO4-+S2O32-+H+ SO42-+Mn2++H2O 未配平)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。基态Ti原子电子占据的最高能层符号________,基态Ti2+的价电子的电子排布式 。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H22NH3实现储氢和输氢.下列说法正确的是_________(填序号);
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH4+与C1O4-、PH4+、CH4、BH4-互为等电子体
c.相同压强时,NH3的沸点比PH3的沸点高
d.电负性C<N<O , 第一电离能C< O < N
(3)Se与O同族,则 SeO2分子的空间构型为
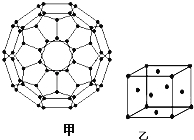
(4)富勒烯(C60)的结构如图甲,分子中碳原子轨道的杂化类型为 ;1mol C60分子中σ键的数目为 个.
(5)图乙为一个金属铜的晶胞,此晶胞立方体的边长为a pm,Cu的相对原子质量为64,金属铜的密度为ρ g/cm3,则阿伏加德罗常数可表示为 mol﹣1(用含a、ρ的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F、G七种物质,C、F是最常见的金属,B是气体单质,D为FeSO4溶液,G为CuSO4溶液,它们之间存在如图所示关系:
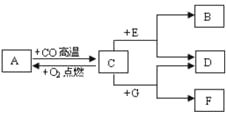
(1)推测下列物质的化学式A ,B ,F 。
(2)写出A→C转化的化学方程式 。
(3)写出C+G→D+F转化的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生.下列属于未来新能源标准的是( ) ①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能.
A.①②③④
B.⑤⑥⑦⑧
C.①③⑤⑥⑦⑧
D.③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将224 L HCl气体溶于635 mL水中,所得盐酸的密度为1.18g·cm-3。试计算:
(1)所得盐酸的质量分数和物质的量浓度分别是________、________。
(2)取出这种盐酸100 mL,稀释至1.18 L,所得稀盐酸的物质的量浓度是________。
(3)在40.0 mL 0.065 mol·L-1 Na2CO3溶液中,逐渐加入(2)所稀释的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过________mL。
(4)将不纯的NaOH样品1 g(样品含少量Na2CO3和水),放入50 mL 2 mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL 1 mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到________克固体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com