
 ��
��| 5 |
| 2 |
|
0.001mol��
| ||
| 6g |
0.003mol��
| ||
| 6g |


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ñ��ɽ���ˮ�еĵ���ȡ���� |
| B���ù��˷�����Fe��OH��3�����FeCl3��Һ�Ļ���� |
| C���ýᾧ���ᴿNaCl��KNO3�Ļ�����е�KNO3 |
| D����ȥFeCl2��Һ�е�����FeCl3������������м����ַ�Ӧ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����������̼̼˫��������̼̼���� |
| B��������6��̼̼����ȫ��ͬ |
| C������̼ԭ�Ӷ���ͬһƽ���ϣ���ԭ�Ӳ�����ͬһƽ���� |
| D��ÿ������֮��ļнǶ�Ϊ60�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��һ�������£���������������������·�Ӧ��
��һ�������£���������������������·�Ӧ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��-CH3�������ĵ���ʽΪ  |
B���������Ľṹ��ʽ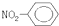 |
| C����ϩ�Ľṹ��ʽCH2CH2 |
| D�����ķ���ʽC6H6 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com