
| A. | 某无色溶液中滴入石蕊试液后溶液呈蓝色,证明该溶液一定是碱的溶液 | |
| B. | 向某无色溶液中滴入硝酸银溶液产生白色沉淀,证明该溶液一定是盐酸 | |
| C. | 某白色固体与熟石灰混合研磨后产生有刺激性的氨味,证明该固体是铵盐 | |
| D. | 向某固体中加入稀盐酸产生气泡,证明该固体一定是碳酸盐 |
分析 根据实验的现象来分析出现这一现象的原因,并注意离子之间的相互影响来作出合理的判断.
A、无色溶液中滴入石蕊试液后溶液呈蓝色,根据酚酞的变色范围可知,该溶液显碱性;
B、无色溶液中滴入硝酸银溶液,产生白色沉淀,沉淀可能为氯化银,也可能是碳酸银等;
C、使湿润红色石蕊试纸变蓝的气体为氨气;
D、向某固体中加入稀盐酸产生气泡,气体可以是二氧化碳或是二氧化硫.
解答 解:A、无色溶液中滴入石蕊试液后溶液呈蓝色,根据酚酞的变色范围可知,该溶液显碱性,但不一定是碱溶液,如碳酸钠溶液属于盐溶液也可使酚酞变红,故A错误;
B、无色溶液中滴入硝酸银溶液,产生白色沉淀,沉淀可能为氯化银,也可能是碳酸银等,则溶液可能为盐酸或碳酸钠溶液等,故B错误;
C、使湿润红色石蕊试纸变蓝的气体为氨气,则白色固体与熟石灰共热生成氨气,即白色固体为铵盐,故C正确;
D、向某固体中加入稀盐酸产生气泡,气体可以是二氧化碳或是二氧化硫,证明该固体可能是碳酸盐、碳酸氢盐、亚硫酸盐等,故D错误.
故选C.
点评 本题考查了常见离子及常见物质的检验,学生应明确物质的性质、明确出现现象的原因,能用具体的实例来分析解决问题.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
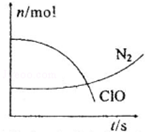
| A. | 还原剂是含CN-的物质,氧化产物不只有N2 | |
| B. | 氧化剂是ClO-,还原产物是HCO3- | |
| C. | 参与反应的氧化剂与还原剂的物质的量之比为5:2 | |
| D. | 标准状况下若生成2.24LN2则转移电子1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2CO3和NaHCO3形成的混合溶液中:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| B. | 0.1mol•L-1NaHSO3溶液中通入NH3至溶液pH=7:c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 物质的量浓度相等的:①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4Cl溶液、④(NH4)2Fe(SO4)2溶液中c(NH4+)的大小关系:④>①>②>③ | |
| D. | 0.1mol•L-1CH3COONa溶液中通入HCl至溶液pH=7:c(Na+)>c(CH3COOH)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 高锰酸钾溶液体积(ml) | 废水样品的体积(ml) |
| 1 | 10.02 | 25.00 |
| 2 | 10.62 | 25.00 |
| 3 | 9.98 | 25.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将标准状况下1.12 L NH3溶于500 mL水中 | |
| B. | 将标准状况下1.12 L NH3溶于水配成500 mL溶液 | |
| C. | 取1 mol•L-1的氨水50 mL,加入500 mL水中 | |
| D. | 取1 mol•L-1的氨水100 mL,配成1 000 mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
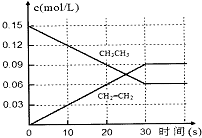 乙烯是重要的化工原料,用乙烷脱氢制乙烯:
乙烯是重要的化工原料,用乙烷脱氢制乙烯:| 化学键 | C-H | C-C | C=C | H-H |
| 键能(kJ.mol-1) | 412 | 348 | 612 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 密闭容器中反应达到平衡,t0时改变某一条件有如图变化所示,则改变的条件只能是加入催化剂 | |
| B. | 反应达到平衡时外界条件对平衡影响关系如图B所示,则正反应为放热反应,且a>b | |
| C. | 物质的量和温度关系如图C所示,则该反应的正反应为放热反应 | |
| D. | 反应速率和反应条件变化关系如图D所示,则该反应的正反应为放热反应,且A、B、C、D均为气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com